Ley General de los Gases Ideales
Storyboard 
Las tres leyes de los gases (ley de Boyle-Mariotte, ley de Charles, ley de Gay-Lussac) y el principio de Avogadro pueden combinarse en una sola ley denominada la ley de los gases ideales.
Esto permite predecir la variación de uno de los parámetros que definen el estado del gas (la presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$)) para un gas ideal, basándose en el estado inicial y cualquier estado final definido por las otras tres variables restantes.
ID:(1476, 0)
Mecanismos
Definición 
La ley universal de los gases, también conocida como ley de los gases ideales, describe la relación entre la presión, el volumen, la temperatura y el número de moles de un gas. Combina varias leyes de los gases, incluyendo la ley de Boyle, la ley de Charles y el principio de Avogadro, en una sola ecuación. Esta ley establece que el producto de la presión y el volumen de un gas es directamente proporcional al producto de su temperatura y el número de moles de gas. La ley de los gases ideales asume que los gases están compuestos por un gran número de moléculas en constante movimiento aleatorio y que las interacciones entre estas moléculas son insignificantes. Esta ley es fundamental para predecir el comportamiento de los gases bajo diversas condiciones y se utiliza ampliamente tanto en la investigación científica como en aplicaciones prácticas, como la ingeniería y la química.
ID:(15258, 0)
Leyes de los Gases
Imagen 
El estado de un sistema se describe mediante la llamada ecuación de estado, que establece la relación entre los parámetros que caracterizan dicho sistema.
En el caso de los gases, los parámetros que describen su estado son la presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$). Generalmente, este último parámetro se mantiene constante, ya que está relacionado con la cantidad de gas presente.
La ecuación de estado relaciona, por lo tanto, la presión, el volumen y la temperatura, y establece que existen solo dos grados de libertad, ya que la ecuación de estado permite calcular el tercer parámetro. En particular, si se fija el volumen, se puede elegir, por ejemplo, la temperatura como variable, lo que permite calcular la presión correspondiente.
ID:(587, 0)
Integrando las leyes de los gases
Nota 
Las tres leyes de los gases que relacionan la presión ($p$), el volumen ($V$) y la temperatura absoluta ($T$) son:
• La ley de Boyle, que establece que a temperatura constante, el producto de la presión y el volumen de un gas es constante:
| $ p V = C_b $ |
• La ley de Charles, que establece que a presión constante, el volumen de un gas es directamente proporcional a su temperatura absoluta:
| $\displaystyle\frac{ V }{ T } = C_c$ |
• La ley de Gay-Lussac, que establece que a volumen constante, la presión de un gas es directamente proporcional a su temperatura absoluta:
| $\displaystyle\frac{ p }{ T } = C_g$ |
Estas leyes se pueden representar gráficamente como se muestra en la siguiente imagen:
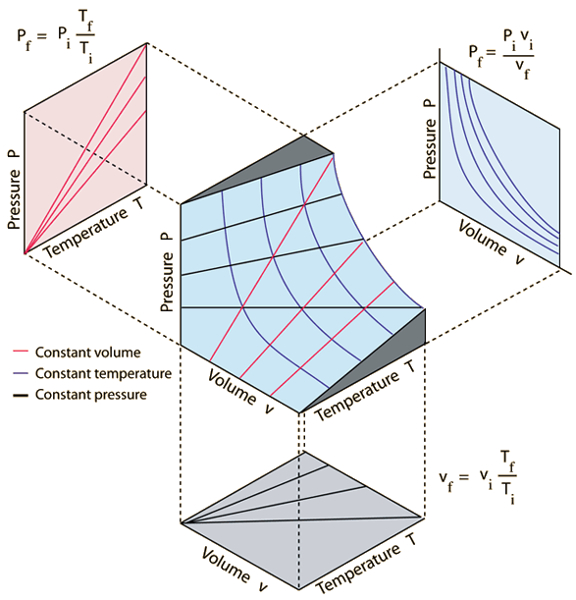
Diagram presión, volumen, temperatura de un gas ideal (http://hyperphysics.phy-astr.gsu.edu)
En 1834, Émile Clapeyron [1] reconoció que la presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$) se relacionan mediante la ley de Boyle, la ley de Charles, la ley de Gay-Lussac y la ley de Avogadro. Estas leyes pueden ser expresadas de manera más general como:
$\displaystyle\frac{pV}{nT} = \text{cte}$
Esta relación general establece que el producto de la presión y el volumen dividido por el número de moles y la temperatura se mantiene constante:
| $ p V = n R_C T $ |
En esta ecuación, la constante universal de los gases ($R_C$) asume el valor de 8.314 J/K·mol.
[1] "Mémoire sur la puissance motrice de la chaleur" (Memoria sobre el poder motriz del calor), Émile Clapeyron, Journal de l'École Polytechnique, 1834.
ID:(9525, 0)
Cambio de estado de un gas Ideal según ley general de los gases
Cita 
La ley de los gases ideales es
| $ p V = n R_C T $ |
se puede expresar como
$\displaystyle\frac{pV}{nT} = R$
Esto implica que las condiciones iniciales y finales deben cumplir con la igualdad
$\displaystyle\frac{p_iV_i}{n_iT_i} = R = \displaystyle\frac{p_fV_f}{n_fT_f}$
Así obtenemos la siguiente ecuación:
| $\displaystyle\frac{ p_i V_i }{ n_i T_i }=\displaystyle\frac{ p_f V_f }{ n_f T_f }$ |
ID:(15683, 0)
Presión en función de la concentración molar
Ejercicio 
Cuando la presión ($p$) se comporta como un gas ideal, cumpliendo con el volumen ($V$), el número de moles ($n$), la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$), la ecuación de los gases:
| $ p V = n R_C T $ |
y la definición de la concentración molar ($c_m$):
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
llevan a la siguiente relación:
| $ p = c_m R_C T $ |
ID:(15684, 0)
Ley específica de los gases
Ecuación 
La presión ($p$) se asocia a el volumen ($V$), ERROR:6679, la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) mediante la ecuación:
| $ p V = n R_C T $ |
Dado que ERROR:6679 puede calcularse con la masa ($M$) y la masa molar ($M_m$) mediante:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
y se obtiene con la definición de la constante específica de los gases ($R_s$) mediante:
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
concluimos que:
| $ p V = M R_s T $ |
ID:(15685, 0)
Presión en función de la densidad
Script 
Si introducimos la ecuación de los gases escrita con la presión ($p$), el volumen ($V$), la masa ($M$), la constante específica de los gases ($R_s$) y la temperatura absoluta ($T$) como:
| $ p V = M R_s T $ |
y utilizamos la definición la densidad ($\rho$) dada por:
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
podemos derivar una ecuación específica para los gases de la siguiente manera:
| $ p = \rho R_s T $ |
ID:(15686, 0)
Ley General de los Gases Ideales
Descripción 
Las tres leyes de los gases (ley de Boyle-Mariotte, ley de Charles, ley de Gay-Lussac) y el principio de Avogadro pueden combinarse en una sola ley denominada la ley de los gases ideales. Esto permite predecir la variación de uno de los parámetros que definen el estado del gas (5224, 5226, 5177 y 9339) para un gas ideal, basándose en el estado inicial y cualquier estado final definido por las otras tres variables restantes.
Variables
Cálculos
Cálculos
Ecuaciones
La presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$) est n vinculados a trav s de las siguientes leyes f sicas:
• La ley de Boyle
| $ p V = C_b $ |
• La ley de Charles
| $\displaystyle\frac{ V }{ T } = C_c$ |
• La ley de Gay-Lussac
| $\displaystyle\frac{ p }{ T } = C_g$ |
• La ley de Avogadro
| $\displaystyle\frac{ n }{ V } = C_a $ |
Estas leyes pueden ser expresadas de manera m s general como:
$\displaystyle\frac{pV}{nT}=cte$
Esta relaci n general establece que el producto de la presi n y el volumen dividido por el n mero de moles y la temperatura se mantiene constante:
| $ p V = n R_C T $ |
(ID 3183)
La presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$) est n vinculados a trav s de las siguientes leyes f sicas:
• La ley de Boyle
| $ p V = C_b $ |
• La ley de Charles
| $\displaystyle\frac{ V }{ T } = C_c$ |
• La ley de Gay-Lussac
| $\displaystyle\frac{ p }{ T } = C_g$ |
• La ley de Avogadro
| $\displaystyle\frac{ n }{ V } = C_a $ |
Estas leyes pueden ser expresadas de manera m s general como:
$\displaystyle\frac{pV}{nT}=cte$
Esta relaci n general establece que el producto de la presi n y el volumen dividido por el n mero de moles y la temperatura se mantiene constante:
| $ p V = n R_C T $ |
(ID 3183)
Cuando la presión ($p$) se comporta como un gas ideal, cumpliendo con el volumen ($V$), el número de moles ($n$), la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$), la ecuaci n de los gases:
| $ p V = n R_C T $ |
y la definici n de la concentración molar ($c_m$):
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
llevan a la siguiente relaci n:
| $ p = c_m R_C T $ |
(ID 4479)
Cuando la presión ($p$) se comporta como un gas ideal, cumpliendo con el volumen ($V$), el número de moles ($n$), la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$), la ecuaci n de los gases:
| $ p V = n R_C T $ |
y la definici n de la concentración molar ($c_m$):
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
llevan a la siguiente relaci n:
| $ p = c_m R_C T $ |
(ID 4479)
La presión ($p$) se asocia a el volumen ($V$), ERROR:6679, la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) mediante la ecuaci n:
| $ p V = n R_C T $ |
Dado que ERROR:6679 puede calcularse con la masa ($M$) y la masa molar ($M_m$) mediante:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
y se obtiene con la definici n de la constante específica de los gases ($R_s$) mediante:
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
concluimos que:
| $ p V = M R_s T $ |
(ID 8831)
La presión ($p$) se asocia a el volumen ($V$), ERROR:6679, la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) mediante la ecuaci n:
| $ p V = n R_C T $ |
Dado que ERROR:6679 puede calcularse con la masa ($M$) y la masa molar ($M_m$) mediante:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
y se obtiene con la definici n de la constante específica de los gases ($R_s$) mediante:
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
concluimos que:
| $ p V = M R_s T $ |
(ID 8831)
Si introducimos la ecuaci n de los gases escrita con la presión ($p$), el volumen ($V$), la masa ($M$), la constante específica de los gases ($R_s$) y la temperatura absoluta ($T$) como:
| $ p V = M R_s T $ |
y utilizamos la definici n la densidad ($\rho$) dada por:
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
podemos derivar una ecuaci n espec fica para los gases de la siguiente manera:
| $ p = \rho R_s T $ |
(ID 8833)
Si introducimos la ecuaci n de los gases escrita con la presión ($p$), el volumen ($V$), la masa ($M$), la constante específica de los gases ($R_s$) y la temperatura absoluta ($T$) como:
| $ p V = M R_s T $ |
y utilizamos la definici n la densidad ($\rho$) dada por:
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
podemos derivar una ecuaci n espec fica para los gases de la siguiente manera:
| $ p = \rho R_s T $ |
(ID 8833)
La ley de los gases ideales es
| $ p V = n R_C T $ |
se puede expresar como
$\displaystyle\frac{pV}{nT} = R$
Esto implica que las condiciones iniciales y finales deben cumplir con la igualdad
$\displaystyle\frac{p_iV_i}{n_iT_i} = R = \displaystyle\frac{p_fV_f}{n_fT_f}$
As obtenemos la siguiente ecuaci n:
| $\displaystyle\frac{ p_i V_i }{ n_i T_i }=\displaystyle\frac{ p_f V_f }{ n_f T_f }$ |
(ID 9526)
Ejemplos
La ley universal de los gases, tambi n conocida como ley de los gases ideales, describe la relaci n entre la presi n, el volumen, la temperatura y el n mero de moles de un gas. Combina varias leyes de los gases, incluyendo la ley de Boyle, la ley de Charles y el principio de Avogadro, en una sola ecuaci n. Esta ley establece que el producto de la presi n y el volumen de un gas es directamente proporcional al producto de su temperatura y el n mero de moles de gas. La ley de los gases ideales asume que los gases est n compuestos por un gran n mero de mol culas en constante movimiento aleatorio y que las interacciones entre estas mol culas son insignificantes. Esta ley es fundamental para predecir el comportamiento de los gases bajo diversas condiciones y se utiliza ampliamente tanto en la investigaci n cient fica como en aplicaciones pr cticas, como la ingenier a y la qu mica.
(ID 15258)
El estado de un sistema se describe mediante la llamada ecuaci n de estado, que establece la relaci n entre los par metros que caracterizan dicho sistema.
En el caso de los gases, los par metros que describen su estado son la presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$). Generalmente, este ltimo par metro se mantiene constante, ya que est relacionado con la cantidad de gas presente.
La ecuaci n de estado relaciona, por lo tanto, la presi n, el volumen y la temperatura, y establece que existen solo dos grados de libertad, ya que la ecuaci n de estado permite calcular el tercer par metro. En particular, si se fija el volumen, se puede elegir, por ejemplo, la temperatura como variable, lo que permite calcular la presi n correspondiente.
(ID 587)
Las tres leyes de los gases que relacionan la presión ($p$), el volumen ($V$) y la temperatura absoluta ($T$) son:
• La ley de Boyle, que establece que a temperatura constante, el producto de la presi n y el volumen de un gas es constante:
| $ p V = C_b $ |
• La ley de Charles, que establece que a presi n constante, el volumen de un gas es directamente proporcional a su temperatura absoluta:
| $\displaystyle\frac{ V }{ T } = C_c$ |
• La ley de Gay-Lussac, que establece que a volumen constante, la presi n de un gas es directamente proporcional a su temperatura absoluta:
| $\displaystyle\frac{ p }{ T } = C_g$ |
Estas leyes se pueden representar gr ficamente como se muestra en la siguiente imagen:

Diagram presi n, volumen, temperatura de un gas ideal (http://hyperphysics.phy-astr.gsu.edu)
En 1834, mile Clapeyron [1] reconoci que la presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$) se relacionan mediante la ley de Boyle, la ley de Charles, la ley de Gay-Lussac y la ley de Avogadro. Estas leyes pueden ser expresadas de manera m s general como:
$\displaystyle\frac{pV}{nT} = \text{cte}$
Esta relaci n general establece que el producto de la presi n y el volumen dividido por el n mero de moles y la temperatura se mantiene constante:
| $ p V = n R_C T $ |
En esta ecuaci n, la constante universal de los gases ($R_C$) asume el valor de 8.314 J/K mol.
[1] "M moire sur la puissance motrice de la chaleur" (Memoria sobre el poder motriz del calor), mile Clapeyron, Journal de l' cole Polytechnique, 1834.
(ID 9525)
La ley de los gases ideales es
| $ p V = n R_C T $ |
se puede expresar como
$\displaystyle\frac{pV}{nT} = R$
Esto implica que las condiciones iniciales y finales deben cumplir con la igualdad
$\displaystyle\frac{p_iV_i}{n_iT_i} = R = \displaystyle\frac{p_fV_f}{n_fT_f}$
As obtenemos la siguiente ecuaci n:
| $\displaystyle\frac{ p_i V_i }{ n_i T_i }=\displaystyle\frac{ p_f V_f }{ n_f T_f }$ |
(ID 15683)
Cuando la presión ($p$) se comporta como un gas ideal, cumpliendo con el volumen ($V$), el número de moles ($n$), la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$), la ecuaci n de los gases:
| $ p V = n R_C T $ |
y la definici n de la concentración molar ($c_m$):
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
llevan a la siguiente relaci n:
| $ p = c_m R_C T $ |
(ID 15684)
La presión ($p$) se asocia a el volumen ($V$), ERROR:6679, la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) mediante la ecuaci n:
| $ p V = n R_C T $ |
Dado que ERROR:6679 puede calcularse con la masa ($M$) y la masa molar ($M_m$) mediante:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
y se obtiene con la definici n de la constante específica de los gases ($R_s$) mediante:
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
concluimos que:
| $ p V = M R_s T $ |
(ID 15685)
Si introducimos la ecuaci n de los gases escrita con la presión ($p$), el volumen ($V$), la masa ($M$), la constante específica de los gases ($R_s$) y la temperatura absoluta ($T$) como:
| $ p V = M R_s T $ |
y utilizamos la definici n la densidad ($\rho$) dada por:
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
podemos derivar una ecuaci n espec fica para los gases de la siguiente manera:
| $ p = \rho R_s T $ |
(ID 15686)
(ID 15317)
La presión ($p$), el volumen ($V$), la temperatura absoluta ($T$), y el número de moles ($n$) est n relacionados por la siguiente ecuaci n:
| $ p V = n R_C T $ |
donde la constante universal de los gases ($R_C$) tiene el valor de 8.314 J/K mol.
(ID 3183)
La presión ($p$), el volumen ($V$), la temperatura absoluta ($T$), y el número de moles ($n$) est n relacionados por la siguiente ecuaci n:
| $ p V = n R_C T $ |
donde la constante universal de los gases ($R_C$) tiene el valor de 8.314 J/K mol.
(ID 3183)
Para un estado inicial (la presión en estado inicial ($p_i$), el volumen en estado i ($V_i$), la temperatura en estado inicial ($T_i$) y el número de moles en estado i ($n_i$)) y un estado final (la presión en estado final ($p_f$), el volumen en estado f ($V_f$), la temperatura en estado final ($T_f$) y el número de moles en estado f ($n_f$)), se cumple que:
| $\displaystyle\frac{ p_i V_i }{ n_i T_i }=\displaystyle\frac{ p_f V_f }{ n_f T_f }$ |
(ID 9526)
La presión ($p$) se puede calcular a partir de la concentración molar ($c_m$) utilizando la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) de la siguiente manera:
| $ p = c_m R_C T $ |
(ID 4479)
La presión ($p$) se puede calcular a partir de la concentración molar ($c_m$) utilizando la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) de la siguiente manera:
| $ p = c_m R_C T $ |
(ID 4479)
La presión ($p$) se relaciona con la masa ($M$) mediante el volumen ($V$), la constante específica de los gases ($R_s$) y la temperatura absoluta ($T$) seg n la expresi n:
| $ p V = M R_s T $ |
(ID 8831)
La presión ($p$) se relaciona con la masa ($M$) mediante el volumen ($V$), la constante específica de los gases ($R_s$) y la temperatura absoluta ($T$) seg n la expresi n:
| $ p V = M R_s T $ |
(ID 8831)
Si se trabaja con los datos espec ficos de un gas, se puede definir la constante específica de los gases ($R_s$) en funci n de la constante universal de los gases ($R_C$) y la masa molar ($M_m$), de la siguiente manera:
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
(ID 8832)
Si trabajamos con la masa o la densidad ($\rho$) del gas, podemos establecer una ecuaci n an loga a la de los gases ideales para la presión ($p$) y la temperatura absoluta ($T$), con la nica diferencia de que la constante ser espec fica para cada tipo de gas y se denotar como la constante específica de los gases ($R_s$):
| $ p = \rho R_s T $ |
(ID 8833)
Si trabajamos con la masa o la densidad ($\rho$) del gas, podemos establecer una ecuaci n an loga a la de los gases ideales para la presión ($p$) y la temperatura absoluta ($T$), con la nica diferencia de que la constante ser espec fica para cada tipo de gas y se denotar como la constante específica de los gases ($R_s$):
| $ p = \rho R_s T $ |
(ID 8833)
ID:(1476, 0)
