Número de Moles
Storyboard 
En general las leyes de los gases ideales dependen del numero de partículas y no del tipo de estas. Esto que debido a no considerase interacción entre las partículas (gas ideal) sus propiedades físicas especificas no juegan un rol. Sin embargo el numero de partículas de un volumen de algunos litros de gas es tan grande ($10^{23}$) que es complejo trabajar con este tipo de numero. Por ello se ha definido una escala mas conveniente trabajando con los llamados moles que corresponden a $6.02\times 10^{23}$ partículas.
ID:(1477, 0)
Gas ideal
Imagen 
Un gas en el que sus partículas no interactúan se denomina gas ideal. Podemos imaginarlo de la siguiente manera:
• Consiste en una serie de esferas contenidas dentro de un recipiente un volumen ($V$).
• La velocidad de estas partículas depende de la temperatura absoluta ($T$).
• Generan una presión de ERROR:5224,0 a través de rebotes con las paredes del recipiente.

El gas ideal se caracteriza por la ausencia de energías potenciales entre las partículas. Es decir, las energías potenciales que podrían existir entre las partículas $i$ y $j$ con posiciones $q_i$ y $q_j$ son nulas:
| $V(q_i,q_j)=0$ |
ID:(9528, 0)
Los moles
Nota 
Al emplear el concepto de mol, podemos establecer una relación directa entre la cantidad de sustancia de un gas y la cantidad de partículas de el número de partículas ($N$) presentes en él. Esto simplifica los cálculos y permite una conexión más intuitiva entre la cantidad de gas y las propiedades que lo describen, tales como la presión ($p$), el volumen ($V$) y la temperatura absoluta ($T$).
La constante el número de Avogadro ($N_A$), que es aproximadamente igual a $6,02\times 10^{23}$, representa una constante fundamental en la química y se utiliza para realizar conversiones entre la escala macroscópica y la escala microscópica de los átomos y las moléculas.
El valor de el número de Moles ($n$) se puede calcular a partir de el número de partículas ($N$) y la masa ($M$). En el primer caso, se obtiene dividiendo por ERROR:5403 utilizando la fórmula:
| $ n \equiv\displaystyle\frac{ N }{ N_A }$ |
Mientras que en el segundo caso, se utiliza la masa molar ($M_m$) con la fórmula:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
ID:(9600, 0)
La masa de una partícula
Cita 
Se puede calcular la masa de la partícula ($m$) en general con la masa ($M$) y el número de partículas ($N$) mediante:
| $ m \equiv \displaystyle\frac{ M }{ N }$ |
o con la masa molar ($M_m$) y el número de Avogadro ($N_A$) mediante:
| $ m =\displaystyle\frac{ M_m }{ N_A }$ |
ID:(15697, 0)
La concentración de particulas y moles
Ejercicio 
La concentración de la concentración de particulas ($c_n$) se define en función de el número de partículas ($N$) y el volumen ($V$) mediante:
| $ c_n \equiv \displaystyle\frac{ N }{ V }$ |
o empleando la densidad ($\rho$) y la masa de la partícula ($m$) mediante:
| $ c_n =\displaystyle\frac{ \rho }{ m }$ |
La la concentración molar ($c_m$) se define en función de ERROR:6679 y el volumen ($V$) mediante:
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
o empleando la densidad ($\rho$) y la masa molar ($M_m$) mediante:
| $ c_m =\displaystyle\frac{ \rho }{ M_m }$ |
La relación entre ambas concentraciones es el número de Avogadro ($N_A$) mediante:
| $ c_n = N_A c_m $ |
ID:(15698, 0)
Ecuaciones de los gases ideales
Ecuación 
Las ecuaciones de los gases en general relacionan la presión ($p$), el volumen ($V$), la temperatura absoluta ($T$), la constante universal de los gases ($R_C$) y alguna medida de la cantidad.
Esta medida puede ser genérica empleando la ley de Dalton, en la que solo interesa el número de las partículas y no su tipo.
Para ello, existe la versión en la que se trabaja con ERROR:6679:
| $ p V = n R_C T $ |
y la concentración molar ($c_m$):
| $ p = c_m R_C T $ |
Por otro lado, si se trabaja con el tipo de las moléculas, se debe trabajar con la constante específica de los gases ($R_s$) en vez de la constante universal de los gases ($R_C$):
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
y calcular la cantidad mediante la masa ($M$):
| $ p V = M R_s T $ |
o la densidad ($\rho$):
| $ p = \rho R_s T $ |
ID:(15699, 0)
Mezcla de gases
Script 
En el caso de un gas ideal, donde no hay interacciones entre partículas, una mezcla de diferentes tipos de gases se comportará como si fuera una mayor cantidad del mismo tipo de gas.
Específicamente, si tenemos tres componentes con sus respectivas presiones parciales, al mezclarlos, la presión total será la suma de las presiones parciales:
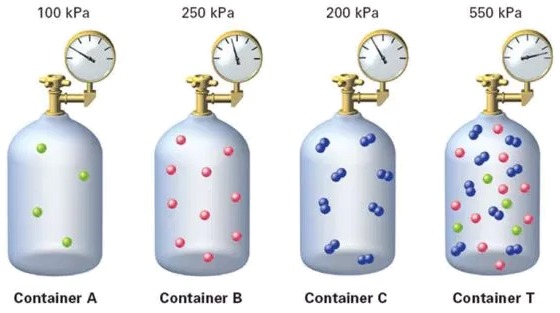
Mezcla de tres tipos de gases A, B y C para obtener un gas total (T) cuya presión sera igual a la suma de las presiones parciales..
Esta imagen ilustra cómo se suman las presiones parciales de los gases en una mezcla. Cada gas ejerce una presión independiente y contribuye a la presión total de la mezcla.
Este concepto es fundamental en la comprensión del comportamiento de las mezclas de gases, ya que nos permite calcular la presión total a partir de las presiones parciales de los componentes individuales.
Según la Ley de Dalton [1], la presión total de una mezcla de gases es igual a la suma de las presiones individuales de los gases, donde una presión ($p$) es igual a la suma de la presión parcial de la componente i ($p_i$). Esto nos lleva a concluir que el gas se comporta como si las partículas de los diferentes gases fueran idénticas. De esta manera, la presión ($p$) es la suma de la presión parcial de la componente i ($p_i$):
| $ p = \displaystyle\sum_i p_i $ |
Por lo tanto, se concluye que el gas se comporta como si los diferentes gases fueran idénticos y el número de moles ($n$) corresponde a la suma de ERROR:9333,0:
| $ n =\displaystyle\sum_i n_i $ |
[1] "Experimental Essays on the Constitution of Mixed Gases; on the Force of Steam or Vapour from Water and Other Liquids in Different Temperatures, Both in a Torricellian Vacuum and in Air; on Evaporation; and on the Expansion of Gases by Heat" (Ensayos experimentales sobre la constitución de gases mixtos; sobre la fuerza del vapor o vapor del agua y otros líquidos a diferentes temperaturas, tanto en el vacío torricelliano como en el aire; sobre evaporación; y sobre la expansión de los gases por el calor), John Dalton, Memoirs of the Literary and Philosophical Society of Manchester, Volume 5, Issue 2, Pages 535-602 (1802).
ID:(9533, 0)
Número de Moles
Descripción 
En general las leyes de los gases ideales dependen del numero de partículas y no del tipo de estas. Esto que debido a no considerase interacción entre las partículas (gas ideal) sus propiedades físicas especificas no juegan un rol. Sin embargo el numero de partículas de un volumen de algunos litros de gas es tan grande ($10^{23}$) que es complejo trabajar con este tipo de numero. Por ello se ha definido una escala mas conveniente trabajando con los llamados moles que corresponden a $6.02\times 10^{23}$ partículas.
Variables
Cálculos
Cálculos
Ecuaciones
La presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$) est n vinculados a trav s de las siguientes leyes f sicas:
• La ley de Boyle
| $ p V = C_b $ |
• La ley de Charles
| $\displaystyle\frac{ V }{ T } = C_c$ |
• La ley de Gay-Lussac
| $\displaystyle\frac{ p }{ T } = C_g$ |
• La ley de Avogadro
| $\displaystyle\frac{ n }{ V } = C_a $ |
Estas leyes pueden ser expresadas de manera m s general como:
$\displaystyle\frac{pV}{nT}=cte$
Esta relaci n general establece que el producto de la presi n y el volumen dividido por el n mero de moles y la temperatura se mantiene constante:
| $ p V = n R_C T $ |
(ID 3183)
Cuando la presión ($p$) se comporta como un gas ideal, cumpliendo con el volumen ($V$), el número de moles ($n$), la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$), la ecuaci n de los gases:
| $ p V = n R_C T $ |
y la definici n de la concentración molar ($c_m$):
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
llevan a la siguiente relaci n:
| $ p = c_m R_C T $ |
(ID 4479)
El número de moles ($n$) corresponde a el número de partículas ($N$) dividido por el número de Avogadro ($N_A$):
| $ n \equiv\displaystyle\frac{ N }{ N_A }$ |
Si multiplicamos el numerador y el denominador por la masa de la partícula ($m$), obtenemos:
$n=\displaystyle\frac{N}{N_A}=\displaystyle\frac{Nm}{N_Am}=\displaystyle\frac{M}{M_m}$
As que es:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
(ID 4854)
La presión ($p$) se asocia a el volumen ($V$), ERROR:6679, la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) mediante la ecuaci n:
| $ p V = n R_C T $ |
Dado que ERROR:6679 puede calcularse con la masa ($M$) y la masa molar ($M_m$) mediante:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
y se obtiene con la definici n de la constante específica de los gases ($R_s$) mediante:
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
concluimos que:
| $ p V = M R_s T $ |
(ID 8831)
Si introducimos la ecuaci n de los gases escrita con la presión ($p$), el volumen ($V$), la masa ($M$), la constante específica de los gases ($R_s$) y la temperatura absoluta ($T$) como:
| $ p V = M R_s T $ |
y utilizamos la definici n la densidad ($\rho$) dada por:
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
podemos derivar una ecuaci n espec fica para los gases de la siguiente manera:
| $ p = \rho R_s T $ |
(ID 8833)
Si se remplaza en la concentraci n molar
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
el numero de moles con
| $ n = \displaystyle\frac{ M }{ M_m }$ |
y se emplea la definici n de la densidad
| $ \rho = \displaystyle\frac{ M }{ V }$ |
se obtiene la relaci n
| $ c_m =\displaystyle\frac{ \rho }{ M_m }$ |
(ID 9527)
En el caso de la Ley de Dalton, tenemos que la presión ($p$) es la suma de la presión parcial de la componente i ($p_i$):
| $ p = \displaystyle\sum_i p_i $ |
Cada componente de la mezcla satisface la ecuaci n de los gases ideales con la presión ($p$), el volumen ($V$), el número de moles ($n$), la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$):
| $ p V = n R_C T $ |
Por lo tanto, la mezcla tambi n cumple la misma ley, donde el número de moles ($n$) es igual a la suma de el número de moles de la componente i ($n_i$):
| $ n =\displaystyle\sum_i n_i $ |
(ID 9534)
Dado la concentración de particulas ($c_n$) con el número de partículas ($N$) y el volumen ($V$), obtenemos:
| $ c_n \equiv \displaystyle\frac{ N }{ V }$ |
Con la masa de la partícula ($m$) y la masa ($M$),
| $ m \equiv \displaystyle\frac{ M }{ N }$ |
Como la densidad ($\rho$) es
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
obtenemos
$c_n=\displaystyle\frac{N}{V}=\displaystyle\frac{M}{mV}=\displaystyle\frac{\rho}{m}$
Por lo tanto,
| $ c_n =\displaystyle\frac{ \rho }{ m }$ |
(ID 10623)
(ID 10624)
Ejemplos
(ID 15259)
Un gas en el que sus part culas no interact an se denomina gas ideal. Podemos imaginarlo de la siguiente manera:
• Consiste en una serie de esferas contenidas dentro de un recipiente un volumen ($V$).
• La velocidad de estas part culas depende de la temperatura absoluta ($T$).
• Generan una presi n de ERROR:5224,0 a trav s de rebotes con las paredes del recipiente.

El gas ideal se caracteriza por la ausencia de energ as potenciales entre las part culas. Es decir, las energ as potenciales que podr an existir entre las part culas $i$ y $j$ con posiciones $q_i$ y $q_j$ son nulas:
| $V(q_i,q_j)=0$ |
(ID 9528)
Al emplear el concepto de mol, podemos establecer una relaci n directa entre la cantidad de sustancia de un gas y la cantidad de part culas de el número de partículas ($N$) presentes en l. Esto simplifica los c lculos y permite una conexi n m s intuitiva entre la cantidad de gas y las propiedades que lo describen, tales como la presión ($p$), el volumen ($V$) y la temperatura absoluta ($T$).
La constante el número de Avogadro ($N_A$), que es aproximadamente igual a $6,02\times 10^{23}$, representa una constante fundamental en la qu mica y se utiliza para realizar conversiones entre la escala macrosc pica y la escala microsc pica de los tomos y las mol culas.
El valor de el número de Moles ($n$) se puede calcular a partir de el número de partículas ($N$) y la masa ($M$). En el primer caso, se obtiene dividiendo por el número de Avogadro ($N_A$) utilizando la f rmula:
| $ n \equiv\displaystyle\frac{ N }{ N_A }$ |
Mientras que en el segundo caso, se utiliza la masa molar ($M_m$) con la f rmula:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
(ID 9600)
Se puede calcular la masa de la partícula ($m$) en general con la masa ($M$) y el número de partículas ($N$) mediante:
| $ m \equiv \displaystyle\frac{ M }{ N }$ |
o con la masa molar ($M_m$) y el número de Avogadro ($N_A$) mediante:
| $ m =\displaystyle\frac{ M_m }{ N_A }$ |
(ID 15697)
La concentraci n de la concentración de particulas ($c_n$) se define en funci n de el número de partículas ($N$) y el volumen ($V$) mediante:
| $ c_n \equiv \displaystyle\frac{ N }{ V }$ |
o empleando la densidad ($\rho$) y la masa de la partícula ($m$) mediante:
| $ c_n =\displaystyle\frac{ \rho }{ m }$ |
La la concentración molar ($c_m$) se define en funci n de ERROR:6679 y el volumen ($V$) mediante:
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
o empleando la densidad ($\rho$) y la masa molar ($M_m$) mediante:
| $ c_m =\displaystyle\frac{ \rho }{ M_m }$ |
La relaci n entre ambas concentraciones es el número de Avogadro ($N_A$) mediante:
| $ c_n = N_A c_m $ |
(ID 15698)
Las ecuaciones de los gases en general relacionan la presión ($p$), el volumen ($V$), la temperatura absoluta ($T$), la constante universal de los gases ($R_C$) y alguna medida de la cantidad.
Esta medida puede ser gen rica empleando la ley de Dalton, en la que solo interesa el n mero de las part culas y no su tipo.
Para ello, existe la versi n en la que se trabaja con ERROR:6679:
| $ p V = n R_C T $ |
y la concentración molar ($c_m$):
| $ p = c_m R_C T $ |
Por otro lado, si se trabaja con el tipo de las mol culas, se debe trabajar con la constante específica de los gases ($R_s$) en vez de la constante universal de los gases ($R_C$):
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
y calcular la cantidad mediante la masa ($M$):
| $ p V = M R_s T $ |
o la densidad ($\rho$):
| $ p = \rho R_s T $ |
(ID 15699)
En el caso de un gas ideal, donde no hay interacciones entre part culas, una mezcla de diferentes tipos de gases se comportar como si fuera una mayor cantidad del mismo tipo de gas.
Espec ficamente, si tenemos tres componentes con sus respectivas presiones parciales, al mezclarlos, la presi n total ser la suma de las presiones parciales:

Mezcla de tres tipos de gases A, B y C para obtener un gas total (T) cuya presi n sera igual a la suma de las presiones parciales..
Esta imagen ilustra c mo se suman las presiones parciales de los gases en una mezcla. Cada gas ejerce una presi n independiente y contribuye a la presi n total de la mezcla.
Este concepto es fundamental en la comprensi n del comportamiento de las mezclas de gases, ya que nos permite calcular la presi n total a partir de las presiones parciales de los componentes individuales.
Seg n la Ley de Dalton [1], la presi n total de una mezcla de gases es igual a la suma de las presiones individuales de los gases, donde una presión ($p$) es igual a la suma de la presión parcial de la componente i ($p_i$). Esto nos lleva a concluir que el gas se comporta como si las part culas de los diferentes gases fueran id nticas. De esta manera, la presión ($p$) es la suma de la presión parcial de la componente i ($p_i$):
| $ p = \displaystyle\sum_i p_i $ |
Por lo tanto, se concluye que el gas se comporta como si los diferentes gases fueran id nticos y el número de moles ($n$) corresponde a la suma de ERROR:9333,0:
| $ n =\displaystyle\sum_i n_i $ |
[1] "Experimental Essays on the Constitution of Mixed Gases; on the Force of Steam or Vapour from Water and Other Liquids in Different Temperatures, Both in a Torricellian Vacuum and in Air; on Evaporation; and on the Expansion of Gases by Heat" (Ensayos experimentales sobre la constituci n de gases mixtos; sobre la fuerza del vapor o vapor del agua y otros l quidos a diferentes temperaturas, tanto en el vac o torricelliano como en el aire; sobre evaporaci n; y sobre la expansi n de los gases por el calor), John Dalton, Memoirs of the Literary and Philosophical Society of Manchester, Volume 5, Issue 2, Pages 535-602 (1802).
(ID 9533)
(ID 15318)
El número de moles ($n$) corresponde a el número de partículas ($N$) dividido por el número de Avogadro ($N_A$):
| $ n \equiv\displaystyle\frac{ N }{ N_A }$ |
el número de Avogadro ($N_A$) es una constante universal cuyo valor es 6.028E+23 1/mol, por lo que no se incluye entre las variables asociadas al c lculo.
(ID 3748)
El número de moles ($n$) se determina dividiendo la masa ($M$) de una sustancia por su la masa molar ($M_m$), que corresponde al peso de un mol de la sustancia.
Por lo tanto, se puede establecer la siguiente relaci n:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
La masa molar se expresa en gramos por mol (g/mol).
(ID 4854)
La masa de la partícula ($m$) puede estimarse a partir de la masa molar ($M_m$) y el número de Avogadro ($N_A$) mediante
| $ m =\displaystyle\frac{ M_m }{ N_A }$ |
(ID 4389)
Si divide la masa ($M$) por el número de partículas ($N$) se obtiene la masa de la partícula ($m$):
| $ m \equiv \displaystyle\frac{ M }{ N }$ |
(ID 12829)
Si dividimos la densidad ($\rho$) por la masa de la partícula ($m$), obtendremos la concentración de particulas ($c_n$):
| $ c_n =\displaystyle\frac{ \rho }{ m }$ |
(ID 10623)
La concentración de particulas ($c_n$) se define como el número de partículas ($N$) dividido por el volumen ($V$):
| $ c_n \equiv \displaystyle\frac{ N }{ V }$ |
(ID 4393)
La concentración molar ($c_m$) corresponde al ERROR:9339,0 por el volumen ($V$) de un gas y se calcula como sigue:
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
(ID 4878)
La concentración molar ($c_m$) puede calcularse a partir de la densidad ($\rho$) y la masa molar ($M_m$) mediante:
| $ c_m =\displaystyle\frac{ \rho }{ M_m }$ |
(ID 9527)
Para convertir la concentración molar ($c_m$) en la concentración de particulas ($c_n$), simplemente multiplique la primera por el número de Avogadro ($N_A$), as :
| $ c_n = N_A c_m $ |
(ID 10624)
Si se trabaja con los datos espec ficos de un gas, se puede definir la constante específica de los gases ($R_s$) en funci n de la constante universal de los gases ($R_C$) y la masa molar ($M_m$), de la siguiente manera:
| $ R_s \equiv \displaystyle\frac{ R_C }{ M_m }$ |
(ID 8832)
La presión ($p$), el volumen ($V$), la temperatura absoluta ($T$), y el número de moles ($n$) est n relacionados por la siguiente ecuaci n:
| $ p V = n R_C T $ |
donde la constante universal de los gases ($R_C$) tiene el valor de 8.314 J/K mol.
(ID 3183)
La presión ($p$) se puede calcular a partir de la concentración molar ($c_m$) utilizando la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) de la siguiente manera:
| $ p = c_m R_C T $ |
(ID 4479)
La presión ($p$) se relaciona con la masa ($M$) mediante el volumen ($V$), la constante específica de los gases ($R_s$) y la temperatura absoluta ($T$) seg n la expresi n:
| $ p V = M R_s T $ |
(ID 8831)
Si trabajamos con la masa o la densidad ($\rho$) del gas, podemos establecer una ecuaci n an loga a la de los gases ideales para la presión ($p$) y la temperatura absoluta ($T$), con la nica diferencia de que la constante ser espec fica para cada tipo de gas y se denotar como la constante específica de los gases ($R_s$):
| $ p = \rho R_s T $ |
(ID 8833)
La presión total de todas las componentes ($p$) es la suma de la i-esima la presión parcial de la componente i ($p_i$):
| $ p = \displaystyle\sum_i p_i $ |
(ID 15361)
El número de moles ($n$) es igual a la suma de el número de moles de la componente i ($n_i$):
| $ n =\displaystyle\sum_i n_i $ |
(ID 9534)
ID:(1477, 0)
