Principio de Avogadro
Storyboard 
El principio de Avogadro establece que la división de el número de moles ($n$) por el volumen ($V$) es constante, siempre que la presión ($p$) y la temperatura absoluta ($T$) sean constantes.
Esto implica que el número de moles ($n$) varía de manera proporcional a el volumen ($V$).
ID:(1475, 0)
Mecanismos
Definición 
El principio de Avogadro establece que volúmenes iguales de gases, a la misma temperatura y presión, contienen el mismo número de moléculas. Esto significa que el volumen de un gas es directamente proporcional al número de moléculas (o moles) presentes cuando la temperatura y la presión se mantienen constantes. El principio es fundamental para entender el comportamiento de los gases y forma la base de la ley de los gases ideales. Permite determinar la cantidad de gas en un volumen dado y es esencial para cálculos que involucran reacciones químicas y mezclas de gases.
ID:(15257, 0)
Variación del volumen y numero de moles
Imagen 
Existen variables intensivas y extensivas. Las primeras son características del estado del sistema y no dependen de su tamaño. Dos ejemplos son la presión ($p$) y la temperatura absoluta ($T$). Si deseamos un sistema más grande en el mismo estado, tanto la presión ($p$) como la temperatura absoluta ($T$) deben permanecer iguales.
La situación es diferente con el volumen ($V$), que es una variable extensiva, lo que significa que si se necesita un sistema más grande, esta variable tendrá que aumentar en la proporción correspondiente. Lo mismo ocurre con el número total de moles ($n$):
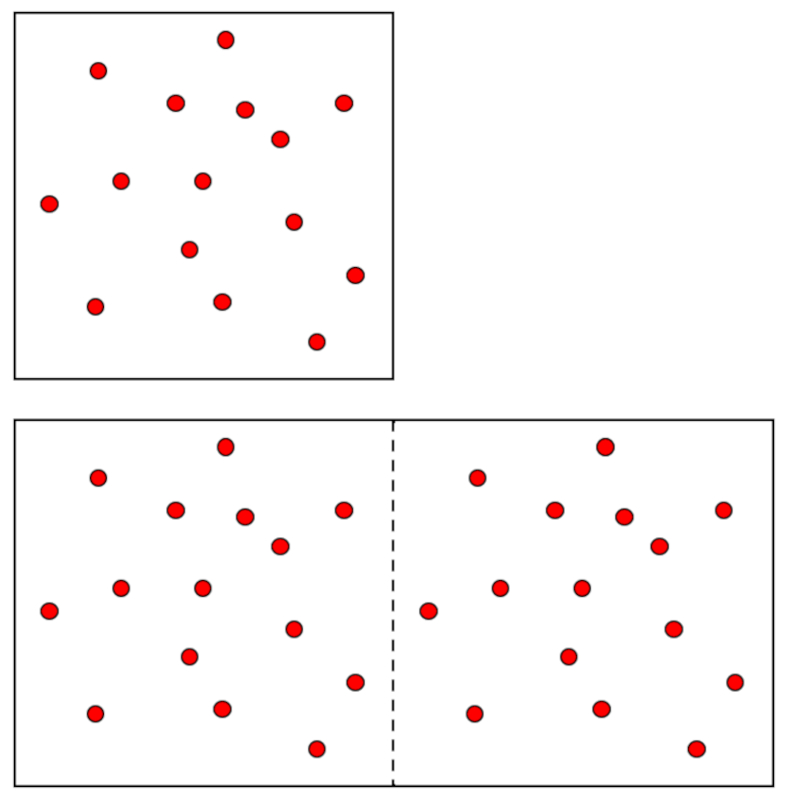
Además, ambas variables deben aumentar en la misma proporción, por lo que, si la presión ($p$) y la temperatura absoluta ($T$) son constantes, serán proporcionales entre sí:
$n \propto V$
ID:(15696, 0)
Relación moles y volumen
Nota 
En un gas, cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$), se observa una variación proporcional entre el volumen ($V$) y el número de moles ($n$). Cada vez que el volumen ($V$) aumenta, se nota un aumento correspondiente en el número de moles ($n$), y viceversa,
$n \propto V$
como se ilustra en el siguiente gráfico:
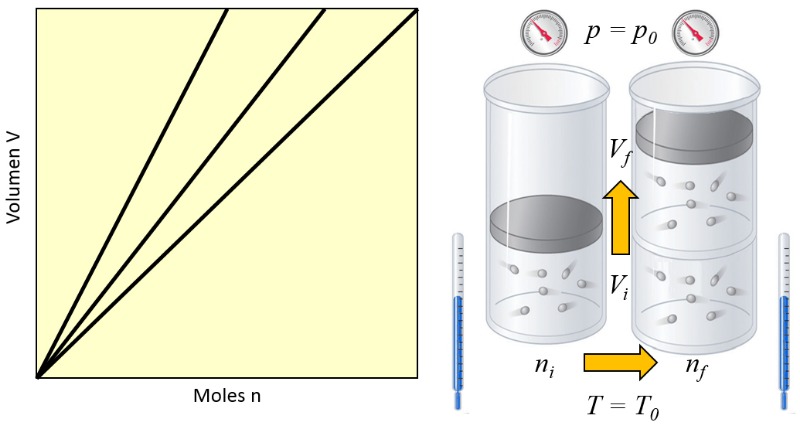
La Ley de Avogadro [1] establece que el volumen ($V$) y el número de moles ($n$) son directamente proporcionales cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$).
Esta relación se puede expresar de la siguiente manera, utilizando la constante del principio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
![]() [1] "Essai d'une manière de déterminer les masses relatives des molécules élémentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons" (Ensayo sobre un método para determinar las masas relativas de las moléculas elementales de las sustancias y las proporciones en las que intervienen en sus combinaciones), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811)
[1] "Essai d'une manière de déterminer les masses relatives des molécules élémentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons" (Ensayo sobre un método para determinar las masas relativas de las moléculas elementales de las sustancias y las proporciones en las que intervienen en sus combinaciones), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811)
ID:(9532, 0)
Amadeo Avogadro
Cita 
Amadeo Avogadro, cuyo nombre completo es Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto, fue un científico italiano nacido el 9 de agosto de 1776 y fallecido el 9 de julio de 1856. Avogadro es conocido principalmente por sus contribuciones al desarrollo de la teoría molecular y la formulación de la ley de Avogadro. Él propuso que volúmenes iguales de gases, a la misma temperatura y presión, contienen un número igual de partículas, lo que ahora se conoce como el principio de Avogadro o la ley de Avogadro. Este concepto fue fundamental en el desarrollo del concepto de mol y proporcionó una base para entender las relaciones entre la cantidad de sustancia, el volumen y el número de partículas en los gases. A pesar de sus importantes contribuciones, el trabajo de Avogadro no fue ampliamente reconocido durante su vida, y sus ideas fueron aceptadas años después de su muerte. Hoy en día, Avogadro es honrado por sus contribuciones fundamentales a la química y es considerado uno de los pioneros de la teoría molecular moderna.
ID:(1659, 0)
Cambio de estado de un gas ideal según la ley de Avogadro
Ejercicio 
El principio de Avogadro establece que cuando la presión ($p$) y la temperatura absoluta ($T$) se mantienen constantes, la proporción de ERROR:6679 a el volumen ($V$) es igual a la constante del principio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
Esto significa que si un gas pasa de un estado inicial (el número de moles en estado i ($n_i$) y el volumen en estado i ($V_i$)) a un estado final (el número de moles en estado f ($n_f$) y el volumen en estado f ($V_f$)) manteniendo la presión ($p$) y la temperatura absoluta ($T$) constantes, la ley de Gay-Lussac siempre debe cumplirse:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Por lo tanto, se tiene:
| $\displaystyle\frac{ n_i }{ V_i }=\displaystyle\frac{ n_f }{ V_f }$ |
ID:(15695, 0)
Principio de Avogadro
Descripción 
El principio de Avogadro establece que la división de 9339 por 5226 es constante, siempre que 5224 y 5177 sean constantes. Esto implica que 9339 varía de manera proporcional a 5226.
Variables
Cálculos
Cálculos
Ecuaciones
El principio de Avogadro establece que cuando la presión ($p$) y la temperatura absoluta ($T$) se mantienen constantes, la proporci n de ERROR:6679 a el volumen ($V$) es igual a la constante del principio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
Esto significa que si un gas pasa de un estado inicial (el número de moles en estado i ($n_i$) y el volumen en estado i ($V_i$)) a un estado final (el número de moles en estado f ($n_f$) y el volumen en estado f ($V_f$)) manteniendo la presión ($p$) y la temperatura absoluta ($T$) constantes, la ley de Gay-Lussac siempre debe cumplirse:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Por lo tanto, se tiene:
| $\displaystyle\frac{ n_i }{ V_i }=\displaystyle\frac{ n_f }{ V_f }$ |
(ID 3489)
Ejemplos
El principio de Avogadro establece que vol menes iguales de gases, a la misma temperatura y presi n, contienen el mismo n mero de mol culas. Esto significa que el volumen de un gas es directamente proporcional al n mero de mol culas (o moles) presentes cuando la temperatura y la presi n se mantienen constantes. El principio es fundamental para entender el comportamiento de los gases y forma la base de la ley de los gases ideales. Permite determinar la cantidad de gas en un volumen dado y es esencial para c lculos que involucran reacciones qu micas y mezclas de gases.
(ID 15257)
Existen variables intensivas y extensivas. Las primeras son caracter sticas del estado del sistema y no dependen de su tama o. Dos ejemplos son la presión ($p$) y la temperatura absoluta ($T$). Si deseamos un sistema m s grande en el mismo estado, tanto la presión ($p$) como la temperatura absoluta ($T$) deben permanecer iguales.
La situaci n es diferente con el volumen ($V$), que es una variable extensiva, lo que significa que si se necesita un sistema m s grande, esta variable tendr que aumentar en la proporci n correspondiente. Lo mismo ocurre con el número total de moles ($n$):

Adem s, ambas variables deben aumentar en la misma proporci n, por lo que, si la presión ($p$) y la temperatura absoluta ($T$) son constantes, ser n proporcionales entre s :
$n \propto V$
(ID 15696)
En un gas, cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$), se observa una variaci n proporcional entre el volumen ($V$) y el número de moles ($n$). Cada vez que el volumen ($V$) aumenta, se nota un aumento correspondiente en el número de moles ($n$), y viceversa,
$n \propto V$
como se ilustra en el siguiente gr fico:

La Ley de Avogadro [1] establece que el volumen ($V$) y el número de moles ($n$) son directamente proporcionales cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$).
Esta relaci n se puede expresar de la siguiente manera, utilizando la constante del principio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
![]() [1] "Essai d'une mani re de d terminer les masses relatives des mol cules l mentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons" (Ensayo sobre un m todo para determinar las masas relativas de las mol culas elementales de las sustancias y las proporciones en las que intervienen en sus combinaciones), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811)
[1] "Essai d'une mani re de d terminer les masses relatives des mol cules l mentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons" (Ensayo sobre un m todo para determinar las masas relativas de las mol culas elementales de las sustancias y las proporciones en las que intervienen en sus combinaciones), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811)
(ID 9532)
Amadeo Avogadro, cuyo nombre completo es Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto, fue un cient fico italiano nacido el 9 de agosto de 1776 y fallecido el 9 de julio de 1856. Avogadro es conocido principalmente por sus contribuciones al desarrollo de la teor a molecular y la formulaci n de la ley de Avogadro. l propuso que vol menes iguales de gases, a la misma temperatura y presi n, contienen un n mero igual de part culas, lo que ahora se conoce como el principio de Avogadro o la ley de Avogadro. Este concepto fue fundamental en el desarrollo del concepto de mol y proporcion una base para entender las relaciones entre la cantidad de sustancia, el volumen y el n mero de part culas en los gases. A pesar de sus importantes contribuciones, el trabajo de Avogadro no fue ampliamente reconocido durante su vida, y sus ideas fueron aceptadas a os despu s de su muerte. Hoy en d a, Avogadro es honrado por sus contribuciones fundamentales a la qu mica y es considerado uno de los pioneros de la teor a molecular moderna.
(ID 1659)
El principio de Avogadro establece que cuando la presión ($p$) y la temperatura absoluta ($T$) se mantienen constantes, la proporci n de ERROR:6679 a el volumen ($V$) es igual a la constante del principio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
Esto significa que si un gas pasa de un estado inicial (el número de moles en estado i ($n_i$) y el volumen en estado i ($V_i$)) a un estado final (el número de moles en estado f ($n_f$) y el volumen en estado f ($V_f$)) manteniendo la presión ($p$) y la temperatura absoluta ($T$) constantes, la ley de Gay-Lussac siempre debe cumplirse:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Por lo tanto, se tiene:
| $\displaystyle\frac{ n_i }{ V_i }=\displaystyle\frac{ n_f }{ V_f }$ |
(ID 15695)
(ID 15316)
La Ley de Avogadro establece que el volumen ($V$) y el número de moles ($n$) son directamente proporcionales cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$).
Esta relaci n se puede expresar de la siguiente manera, utilizando la constante del principio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
(ID 580)
La Ley de Avogadro establece que el volumen ($V$) y el número de moles ($n$) son directamente proporcionales cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$).
Esta relaci n se puede expresar de la siguiente manera, utilizando la constante del principio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
(ID 580)
Si un gas pasa de un estado inicial (i) a un estado final (f) manteniendo constantes la presión ($p$) y la temperatura absoluta ($T$), entonces para el número de moles en estado i ($n_i$), el volumen en estado i ($V_i$), el número de moles en estado f ($n_f$) y el volumen en estado f ($V_f$) se cumple:
| $\displaystyle\frac{ n_i }{ V_i }=\displaystyle\frac{ n_f }{ V_f }$ |
(ID 3489)
ID:(1475, 0)
