Práctico Leyes de los Gases
Storyboard 
En un dispositivo en que se puede modificar presión, volumen y temperatura se definen distintos estados iniciales y explora como este varia modificando cada vez dos de las variables de estado.
ID:(1317, 0)
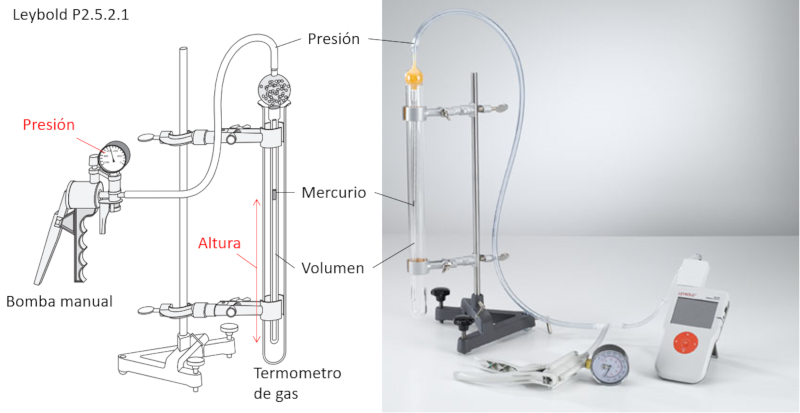
Experimento de la ley de Boyle
Imagen 
Para estudiar la ley de Boyle, se necesitan los siguientes elementos:
• Bomba de aire manual.
• Termómetro de gas con volumen controlado.
El termómetro de gas es un tubo que contiene en su interior otro tubo conectado a la bomba y que posee un pequeño volumen de mercurio.
A través del cilindro externo, se puede fijar la temperatura en la cual se realizará el experimento.
A medida que se aumenta la presión con la bomba, el mercurio se desplaza comprimiendo el volumen que encapsula. De esta forma, se puede medir, para cada presión, el volumen asociado, asegurando que la temperatura se mantenga constante.
Adicionalmente, el mercurio encapsula el volumen, asegurando así que el número de moles se mantenga constante.
ID:(11174, 0)
Experimento de la ley de Boyle, Datos
Nota 
Si se realiza el experimento para una temperatura y moles de gas definidos, se pueden observar datos como los que se listan y se representan en el siguiente gráfico:
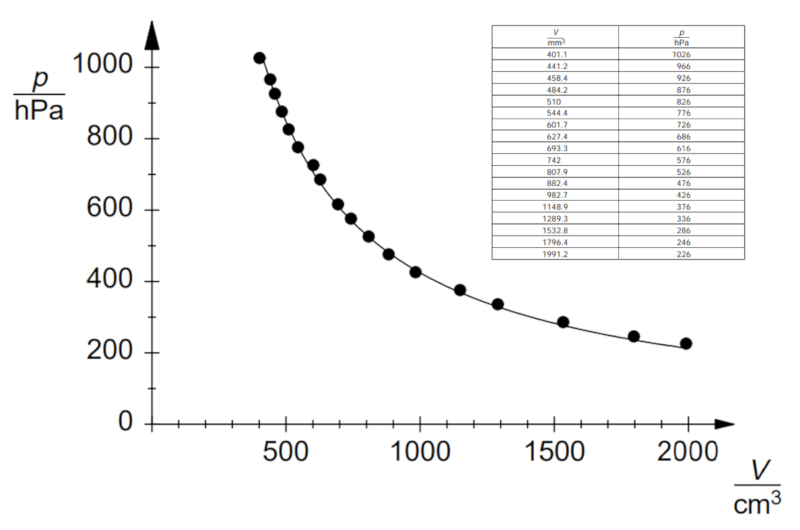
Esto muestra la ley de Boyle, que establece que la presión $p$ y el volumen $V$ varían inversamente de acuerdo con la siguiente relación:
| $ p V = C_b $ |
ID:(11177, 0)
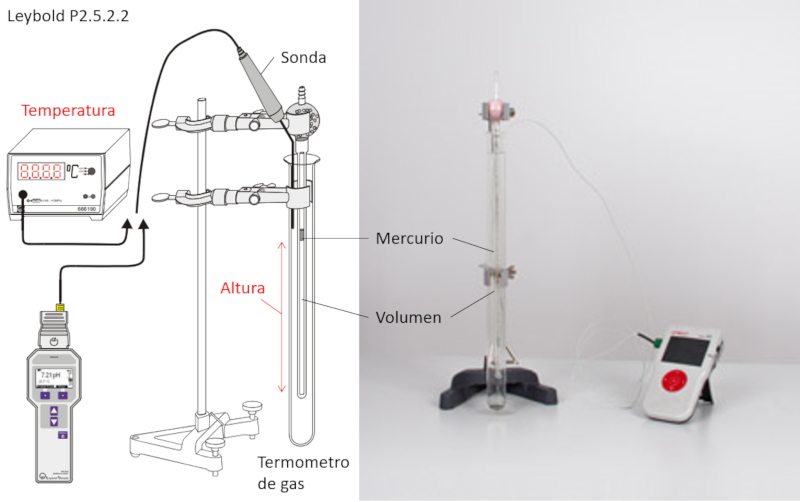
Experimento de la ley de Charles
Cita 
Para estudiar la ley de Charles se requiere del siguiente equipo:
• Un termómetro de gas con volumen controlado.
• Una sonda de medición de temperatura.
En este caso, el cilindro interno del termómetro de gas puede dejarse abierto si se utiliza la presión ambiental, o puede ser sellado con una bomba para mantener una presión definida.
Para realizar la medición, se varía la temperatura en el cilindro externo del termómetro de gas y se mide el valor de la temperatura con la sonda.
Además, se observa cómo se desplaza el volumen del mercurio, ya sea aumentando o reduciendo, lo cual también puede medirse.
Adicionalmente, el mercurio encapsula el volumen, asegurando así que el número de moles se mantenga constante.
ID:(11175, 0)
Experimento de la ley de Charles, Datos
Ejercicio 
Si se lleva a cabo el experimento con una presión y una cantidad de moles de gas definidos, se pueden obtener datos que se enumeran y representan en el siguiente gráfico:
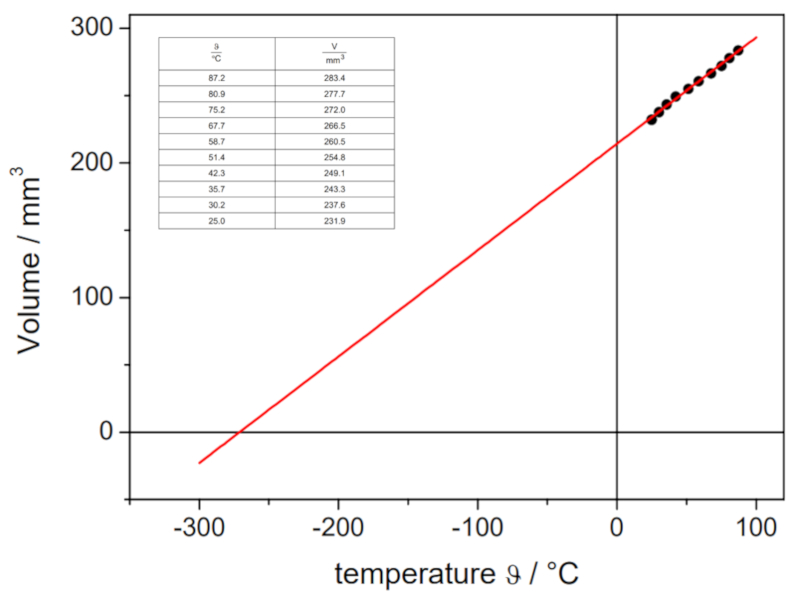
Esto ilustra la ley de Charles, que establece que la temperatura $T$ y el volumen $V$ varían de manera proporcional de acuerdo con la siguiente relación:
| $\displaystyle\frac{ V }{ T } = C_c$ |
ID:(11178, 0)
Experimento de la ley de Gay Lussac
Ecuación 
Para estudiar la ley de Gay-Lussac se requiere de los siguientes equipos:
• Una bomba de aire manual.
• Un termómetro de gas con volumen controlado.
• Una sonda de medición de temperatura.
En este caso, se trabaja con un volumen predefinido.
Para realizar la medición, se varía la temperatura en el cilindro externo del termómetro de gas y se mide el valor de la temperatura con la sonda.
Luego, se modifica la presión utilizando una bomba hasta que el volumen alcance el valor predefinido.
Se repite el experimento con otra temperatura, ajustando nuevamente la presión para lograr el mismo volumen.
Además, el mercurio encapsula el volumen, asegurando así que el número de moles se mantenga constante.

ID:(11176, 0)
Experimento de la ley de Gay Lussac, Datos
Script 
Si se realiza el experimento con un volumen y una cantidad de moles de gas definidos, se pueden obtener datos que se enumeran y representan en el siguiente gráfico:
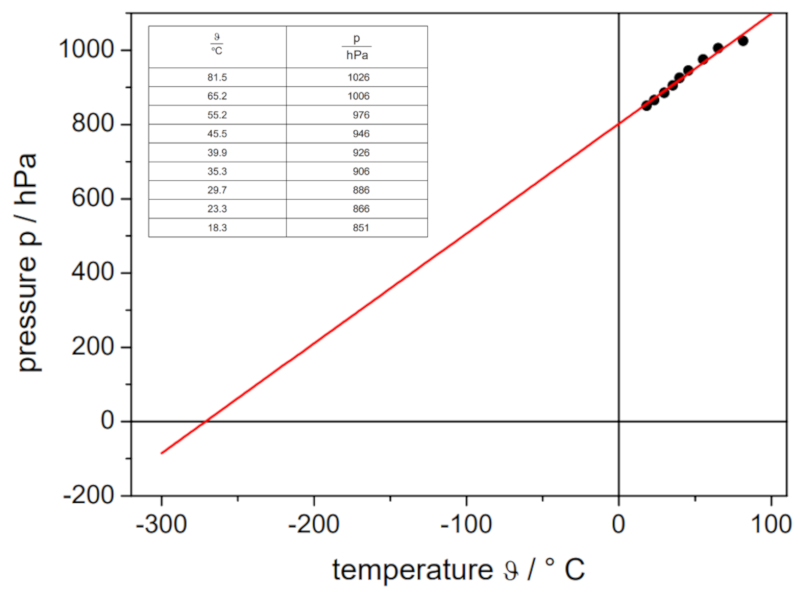
Esto ilustra la ley de Gay-Lussac, que establece que la temperatura $T$ y la presión $p$ varían de manera proporcional de acuerdo con la siguiente relación:
| $\displaystyle\frac{ p }{ T } = C_g$ |
ID:(11180, 0)
Bomba manual
Variable 
Para bombear gas, se construye un instrumento que consta de una cámara y un pistón con dos orificios.
Cada vez que el pistón se retira (succiona), el gas ingresa a la cámara de compresión a través de la abertura que está abierta, mientras que la de salida permanece cerrada.
Luego, cuando se mueve el pistón para generar presión, este se desplaza con el orificio cerrado, comprimiendo el gas hasta que su presión supere la del sistema en el que se busca inyectar el gas. En ese momento, la segunda abertura se abre, permitiendo que el gas comprimido salga y contribuya a seguir aumentando la presión del sistema a comprimir.
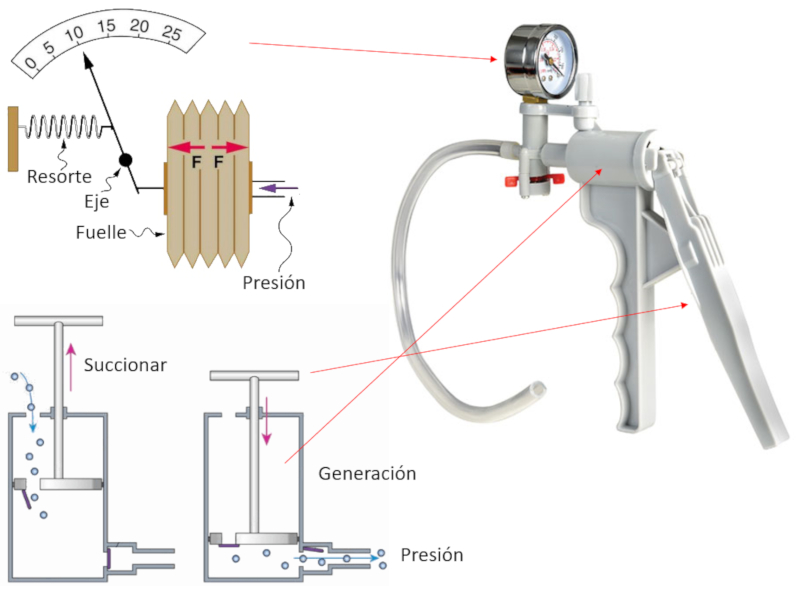
La presión alcanzada se mide mecánicamente a través de una membrana conectada a una aguja que se mueve en función de dicho desplazamiento, indicando así la presión lograda.
ID:(11181, 0)
Termómetro de gas
Audio 
El émbolo con gas se sumerge en el líquido a medir, lo que provoca que el gas se expanda o contraiga con la temperatura. La presión del gas se compensa con la columna de mercurio, y la altura puede calibrarse en función de la temperatura:
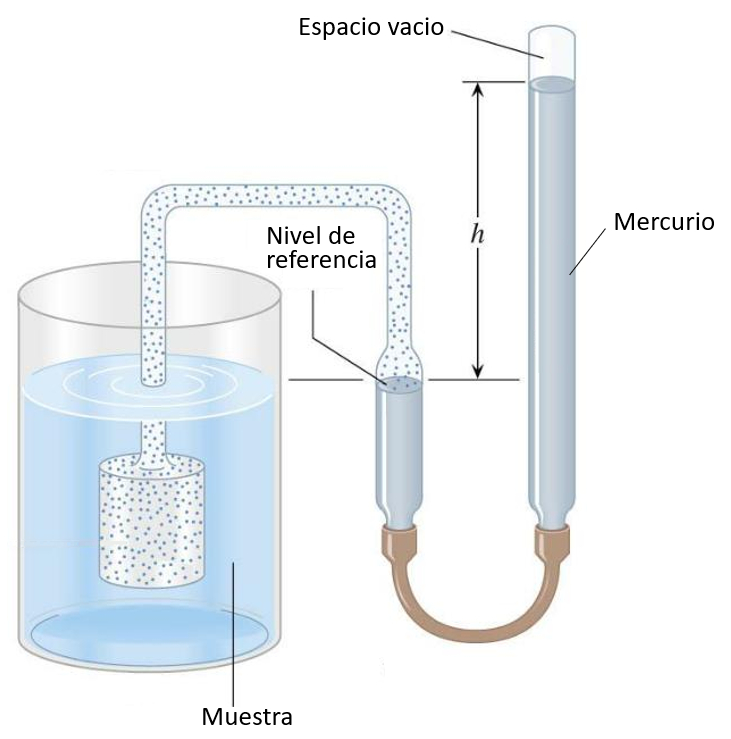
En el caso de los experimentos con gases, se utiliza la cavidad de vacío para encerrar un gas con el cual se desea realizar el experimento. En lugar de utilizar un gas para medir la temperatura, se utiliza este gas para aplicar la presión deseada.
ID:(11179, 0)
