Ley de Gay-Lussac
Storyboard 
La ley de Gay-Lussac establece que la división de la presión ($p$) y la temperatura absoluta ($T$) es constante mientras que el volumen y la cantidad de moles son constantes.
Esto implica que la presión ($p$) varía de manera proporcional a la temperatura absoluta ($T$).
ID:(1474, 0)
Mecanismos
Definición 
La ley de Gay-Lussac establece que la presión de un gas es directamente proporcional a su temperatura cuando el volumen se mantiene constante. Esto significa que, a medida que aumenta la temperatura de un gas, su presión también aumenta, siempre que el volumen no cambie. Inversamente, si la temperatura disminuye, la presión también disminuye. Esta relación es crucial para entender el comportamiento de los gases en recipientes cerrados, donde un aumento de la temperatura provoca un aumento de la presión y una disminución de la temperatura provoca una disminución de la presión.
ID:(15256, 0)
Variación del presión y temperatura
Imagen 
La presión ($p$) se genera cuando las partículas de gas chocan con la superficie del contenedor de gas. Cada choque transmite un momento igual al doble de la masa de la partícula ($m$) por la velocidad media de una partícula ($\bar{v}$). Además, es importante considerar el flujo de partículas hacia la superficie, que depende de la concentración de particulas ($c_n$) pero también de la velocidad media de una partícula ($\bar{v}$) con el que se desplazan. Por lo tanto,
$p \propto c_n v \cdot m v = c_n m v^2$
El flujo de partículas y la transmisión del momento se representan en la siguiente gráfica:
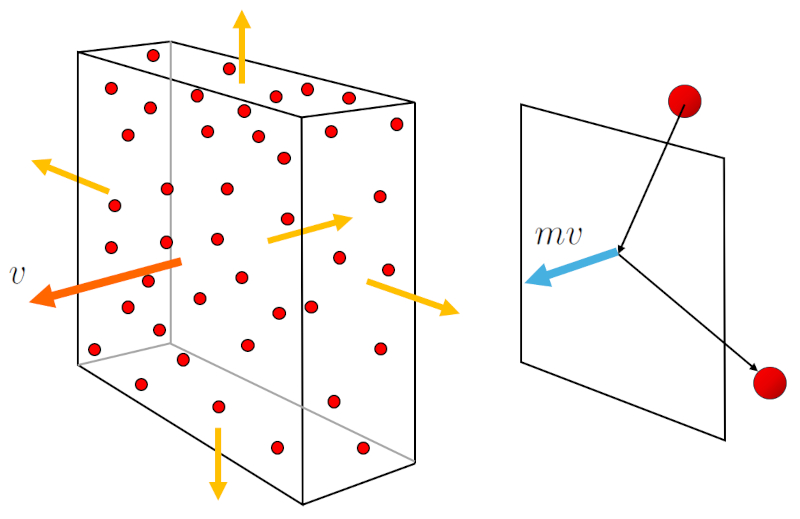
Además, la masa de la partícula ($m$) por la velocidad media de una partícula ($\bar{v}$) al cuadrado es proporcional a la energía de una molécula ($E$), que a su vez es proporcional a la temperatura absoluta ($T$):
$p \propto c_n mv^2 \propto E \propto T$
En este caso, cuando el volumen ($V$) y el número de partículas ($N$) son constantes, también lo es la concentración de particulas ($c_n$).
ID:(15690, 0)
Relación temperatura vs presión
Nota 
En un gas, cuando se mantienen constantes el volumen ($V$) y el número de partículas ($N$), se observa que la presión ($p$) y la temperatura absoluta ($T$) varían de manera proporcional. Cuando la temperatura absoluta ($T$) disminuye, la presión ($p$) también disminuye, y viceversa,
$p \propto T$
como se ilustra en el siguiente gráfico:
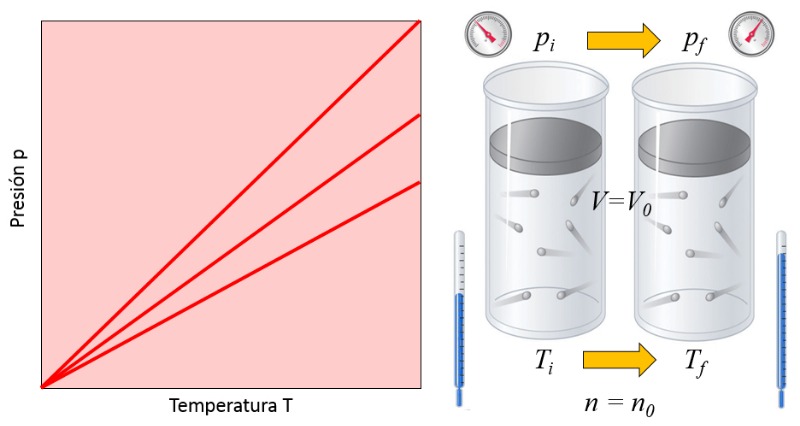
La ley de Gay-Lussac [1] establece que cuando ERROR:5226,0 y el número de partículas ($N$) se mantienen constantes, la presión ($p$) y la temperatura absoluta ($T$) son directamente proporcionales.
Esto se expresa con la constante de la ley de Gay Lussac ($C_g$) de la siguiente manera:
| $\displaystyle\frac{ p }{ T } = C_g$ |
![]() [1] "Mémoire sur la combinaison des substances gazeuses les unes avec les autres" (Memoria sobre la combinación de sustancias gaseosas entre sí), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
[1] "Mémoire sur la combinaison des substances gazeuses les unes avec les autres" (Memoria sobre la combinación de sustancias gaseosas entre sí), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
ID:(9530, 0)
Joseph Louis Gay Lussac
Cita 
Joseph Louis Gay-Lussac fue un químico y físico francés que vivió de 1778 a 1850. Realizó importantes contribuciones en los campos de la química y las leyes de los gases. Gay-Lussac llevó a cabo numerosos experimentos e investigaciones, especialmente sobre las propiedades de los gases, y formuló varias leyes y principios importantes. Uno de sus logros destacados fue el descubrimiento de la ley de los volúmenes combinados, conocida como ley de Gay-Lussac. También contribuyó al estudio de la electrólisis, la medición de la temperatura y la comprensión de las reacciones químicas. El trabajo de Gay-Lussac tuvo una gran influencia en el desarrollo de la química y sentó las bases de las teorías químicas modernas.

Joseph Louis Gay Lussac (1778-1850)
ID:(1658, 0)
Cambio de estado de un gas ideal según la ley de Gay Lussac
Ejercicio 
La ley de Gay-Lussac establece que cuando ERROR:5226,0 y el número de partículas ($N$) se mantienen constantes, la proporción de la presión ($p$) a la temperatura absoluta ($T$) es igual a la constante de la ley de Gay Lussac ($C_g$):
| $\displaystyle\frac{ p }{ T } = C_g$ |
Esto significa que si un gas pasa de un estado inicial (la presión en estado inicial ($p_i$) y la temperatura en estado inicial ($T_i$)) a un estado final (la presión en estado final ($p_f$) y la temperatura en estado final ($T_f$)) manteniendo la presión ($p$) y el número de partículas ($N$) constantes, la ley de Gay-Lussac siempre debe cumplirse:
$\displaystyle\frac{p_i}{T_i}=C_g=\displaystyle\frac{p_f}{T_f}$
Por lo tanto, se tiene:
| $\displaystyle\frac{ p_i }{ T_i }=\displaystyle\frac{ p_f }{ T_f }$ |
ID:(15691, 0)
Ley de Gay-Lussac
Descripción 
La ley de Gay-Lussac establece que la división de 5224 y 5177 es constante mientras que el volumen y la cantidad de moles son constantes. Esto implica que 5224 varía de manera proporcional a 5177.
Variables
Cálculos
Cálculos
Ecuaciones
La ley de Gay-Lussac establece que cuando ERROR:5226,0 y el número de partículas ($N$) se mantienen constantes, la proporci n de la presión ($p$) a la temperatura absoluta ($T$) es igual a la constante de la ley de Gay Lussac ($C_g$):
| $\displaystyle\frac{ p }{ T } = C_g$ |
Esto significa que si un gas pasa de un estado inicial (la presión en estado inicial ($p_i$) y la temperatura en estado inicial ($T_i$)) a un estado final (la presión en estado final ($p_f$) y la temperatura en estado final ($T_f$)) manteniendo la presión ($p$) y el número de partículas ($N$) constantes, la ley de Gay-Lussac siempre debe cumplirse:
$\displaystyle\frac{p_i}{T_i}=C_g=\displaystyle\frac{p_f}{T_f}$
Por lo tanto, se tiene:
| $\displaystyle\frac{ p_i }{ T_i }=\displaystyle\frac{ p_f }{ T_f }$ |
(ID 3490)
Ejemplos
La ley de Gay-Lussac establece que la presi n de un gas es directamente proporcional a su temperatura cuando el volumen se mantiene constante. Esto significa que, a medida que aumenta la temperatura de un gas, su presi n tambi n aumenta, siempre que el volumen no cambie. Inversamente, si la temperatura disminuye, la presi n tambi n disminuye. Esta relaci n es crucial para entender el comportamiento de los gases en recipientes cerrados, donde un aumento de la temperatura provoca un aumento de la presi n y una disminuci n de la temperatura provoca una disminuci n de la presi n.
(ID 15256)
La presión ($p$) se genera cuando las part culas de gas chocan con la superficie del contenedor de gas. Cada choque transmite un momento igual al doble de la masa de la partícula ($m$) por la velocidad media de una partícula ($\bar{v}$). Adem s, es importante considerar el flujo de part culas hacia la superficie, que depende de la concentración de particulas ($c_n$) pero tambi n de la velocidad media de una partícula ($\bar{v}$) con el que se desplazan. Por lo tanto,
$p \propto c_n v \cdot m v = c_n m v^2$
El flujo de part culas y la transmisi n del momento se representan en la siguiente gr fica:

Adem s, la masa de la partícula ($m$) por la velocidad media de una partícula ($\bar{v}$) al cuadrado es proporcional a la energía de una molécula ($E$), que a su vez es proporcional a la temperatura absoluta ($T$):
$p \propto c_n mv^2 \propto E \propto T$
En este caso, cuando el volumen ($V$) y el número de partículas ($N$) son constantes, tambi n lo es la concentración de particulas ($c_n$).
(ID 15690)
En un gas, cuando se mantienen constantes el volumen ($V$) y el número de partículas ($N$), se observa que la presión ($p$) y la temperatura absoluta ($T$) var an de manera proporcional. Cuando la temperatura absoluta ($T$) disminuye, la presión ($p$) tambi n disminuye, y viceversa,
$p \propto T$
como se ilustra en el siguiente gr fico:

La ley de Gay-Lussac [1] establece que cuando ERROR:5226,0 y el número de partículas ($N$) se mantienen constantes, la presión ($p$) y la temperatura absoluta ($T$) son directamente proporcionales.
Esto se expresa con la constante de la ley de Gay Lussac ($C_g$) de la siguiente manera:
| $\displaystyle\frac{ p }{ T } = C_g$ |
![]() [1] "M moire sur la combinaison des substances gazeuses les unes avec les autres" (Memoria sobre la combinaci n de sustancias gaseosas entre s ), Joseph Louis Gay-Lussac, Annales scientifiques de l' .N.S. 3e s rie, tome 3 (1886)
[1] "M moire sur la combinaison des substances gazeuses les unes avec les autres" (Memoria sobre la combinaci n de sustancias gaseosas entre s ), Joseph Louis Gay-Lussac, Annales scientifiques de l' .N.S. 3e s rie, tome 3 (1886)
(ID 9530)
Joseph Louis Gay-Lussac fue un qu mico y f sico franc s que vivi de 1778 a 1850. Realiz importantes contribuciones en los campos de la qu mica y las leyes de los gases. Gay-Lussac llev a cabo numerosos experimentos e investigaciones, especialmente sobre las propiedades de los gases, y formul varias leyes y principios importantes. Uno de sus logros destacados fue el descubrimiento de la ley de los vol menes combinados, conocida como ley de Gay-Lussac. Tambi n contribuy al estudio de la electr lisis, la medici n de la temperatura y la comprensi n de las reacciones qu micas. El trabajo de Gay-Lussac tuvo una gran influencia en el desarrollo de la qu mica y sent las bases de las teor as qu micas modernas.

Joseph Louis Gay Lussac (1778-1850)
(ID 1658)
La ley de Gay-Lussac establece que cuando ERROR:5226,0 y el número de partículas ($N$) se mantienen constantes, la proporci n de la presión ($p$) a la temperatura absoluta ($T$) es igual a la constante de la ley de Gay Lussac ($C_g$):
| $\displaystyle\frac{ p }{ T } = C_g$ |
Esto significa que si un gas pasa de un estado inicial (la presión en estado inicial ($p_i$) y la temperatura en estado inicial ($T_i$)) a un estado final (la presión en estado final ($p_f$) y la temperatura en estado final ($T_f$)) manteniendo la presión ($p$) y el número de partículas ($N$) constantes, la ley de Gay-Lussac siempre debe cumplirse:
$\displaystyle\frac{p_i}{T_i}=C_g=\displaystyle\frac{p_f}{T_f}$
Por lo tanto, se tiene:
| $\displaystyle\frac{ p_i }{ T_i }=\displaystyle\frac{ p_f }{ T_f }$ |
(ID 15691)
(ID 15315)
La ley de Gay-Lussac [1] establece que cuando ERROR:5226,0 y el número de partículas ($N$) se mantienen constantes, la presión ($p$) y la temperatura absoluta ($T$) son directamente proporcionales.
Esto se expresa con la constante de la ley de Gay Lussac ($C_g$) de la siguiente manera:
| $\displaystyle\frac{ p }{ T } = C_g$ |
[1] "M moire sur la combinaison des substances gazeuses les unes avec les autres" (Memoria sobre la combinaci n de sustancias gaseosas entre s ), Joseph Louis Gay-Lussac, Annales scientifiques de l' .N.S. 3e s rie, tome 3 (1886)
(ID 581)
La ley de Gay-Lussac [1] establece que cuando ERROR:5226,0 y el número de partículas ($N$) se mantienen constantes, la presión ($p$) y la temperatura absoluta ($T$) son directamente proporcionales.
Esto se expresa con la constante de la ley de Gay Lussac ($C_g$) de la siguiente manera:
| $\displaystyle\frac{ p }{ T } = C_g$ |
[1] "M moire sur la combinaison des substances gazeuses les unes avec les autres" (Memoria sobre la combinaci n de sustancias gaseosas entre s ), Joseph Louis Gay-Lussac, Annales scientifiques de l' .N.S. 3e s rie, tome 3 (1886)
(ID 581)
Si un gas pasa de un estado inicial (i) a un estado final (f) manteniendo constantes la presión ($p$) y el número de partículas ($N$), se cumple que para la presión en estado inicial ($p_i$), la presión en estado final ($p_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$):
| $\displaystyle\frac{ p_i }{ T_i }=\displaystyle\frac{ p_f }{ T_f }$ |
(ID 3490)
ID:(1474, 0)
