Vapor de Agua en el Suelo
Storyboard 
Normalmente la presión del vapor de agua real es menor que la máxima que soporta del aire antes de comenzar a condensarse este. Por ello se introduce el concepto de humedad relativa.
ID:(377, 0)
Vapor de Agua en el Suelo
Storyboard 
Normalmente la presión del vapor de agua real es menor que la máxima que soporta del aire antes de comenzar a condensarse este. Por ello se introduce el concepto de humedad relativa.
Variables
Cálculos
Cálculos
Ecuaciones
Utilizando la ecuaci n de Clausius-Clapeyron para el gradiente de la presión ($p$) en relaci n con la temperatura absoluta ($T$), que depende de el calor latente ($L$) y la variación de volumen en cambio de fase ($\Delta V$):
En el caso del cambio de fase de l quido a gas, podemos suponer que el cambio de volumen es aproximadamente igual al volumen del vapor, por lo que podemos utilizar la ecuaci n de los gases con el número de moles ($n$), el volumen ($V$), la constante universal de los gases ($R_C$) y la presión de vapor de agua no saturado ($p_v$):
Dado que la ecuaci n de Clausius-Clapeyron se puede expresar como:
$\displaystyle\frac{dp}{dT}=\displaystyle\frac{L}{n}\displaystyle\frac{p}{R T^2}$
Donde el calor latente molar ($l_m$) ($l_m = L/n$) representa el cambio de entalp a en el cambio de fase $\Delta h$ (la energ a necesaria para formar el agua), finalmente obtenemos:
$\displaystyle\frac{dp}{dT}=l_m\displaystyle\frac{p}{RT^2}$
Si integramos esta ecuaci n entre la presión de vapor de agua saturado ($p_s$) y la presi n en el punto
$p_s=p_0e^{l_m/RT_0}e^{-l_m/RT}$
Si evaluamos esta expresi n con los datos del punto cr tico:
$p_{ref}=p_0e^{l_m/RT_0}$
Finalmente, tenemos:
Dado que el diferencial de la energía interna ($dU$) depende de el diferencial inexacto del calor ($\delta Q$), la presión ($p$) y la variación del volumen ($\Delta V$) seg n la ecuaci n:
y la expresi n de la segunda ley de la termodin mica con la temperatura absoluta ($T$) y la variación de la entropía ($dS$) como:
podemos concluir que:
Si se diferencia la definici n de la entalpía ($H$), que depende de la energía interna ($U$), la presión ($p$) y el volumen ($V$), seg n
se obtiene:
$dH = dU + Vdp + pdV$
con el diferencial de la entalpía ($dH$), el diferencial de la energía interna ($dU$), la variación de la presión ($dp$) y la variación del volumen ($\Delta V$).
Con el diferencial de la energía interna ($U$) respecto a la temperatura absoluta ($T$) y la entropía ($S$),
se obtiene:
con el diferencial de la energía interna ($dU$) y la variación de la entropía ($dS$).
Finalmente, se concluye que:
La energía libre de Gibbs ($G$) en funci n de la entalpía ($H$), la entropía ($S$) y la temperatura absoluta ($T$) se expresa de la siguiente manera:
El valor de el diferencial de la energía libre de Gibbs ($dG$) se calcula utilizando el diferencial de la entalpía ($dH$), la variación de la temperatura ($dT$) y la variación de la entropía ($dS$) mediante la ecuaci n:
$dG=dH-SdT-TdS$
Dado que el diferencial de la entalpía ($dH$) est relacionado con el volumen ($V$) y la variación de la presión ($dp$) de acuerdo con:
Se deduce que el diferencial de la entalpía ($dH$), la variación de la entropía ($dS$) y la variación de la presión ($dp$) est n interrelacionados de la siguiente manera:
La relaci n entre la humedad relativa ($RH$) con la concentración de moleculas de vapor de agua ($c_v$) y ERROR:4952,0 se expresa como:
y relacionando la presión ($p$) con la concentración molar ($c_m$), la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) se obtiene:
Esto se aplica a la presi n de vapor de agua, donde:
$p_v = c_v R T$
y a la presi n saturada de vapor de agua:
$p_s = c_s R T$
Lo que resulta en la siguiente ecuaci n:
Cuando la presión ($p$) se comporta como un gas ideal, cumpliendo con el volumen ($V$), el número de moles ($n$), la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$), la ecuaci n de los gases:
y la definici n de la concentración molar ($c_m$):
llevan a la siguiente relaci n:
Como el trabajo se define como la fuerza por el camino recorrido
se tiene que si multiplicamos y dividimos por una secci n $S$
$\delta W = \displaystyle\frac{F}{S}Sdz$
se puede reemplazar el primer termino con la presi n
y el elemento de volumen
con lo que el trabajo en funci n de presi n y volumen es
Con la ley de Clausius-Clapeyron, que depende de la variación de la presión ($dp$), la variación de la temperatura ($dT$), el calor latente ($L$), la variación de volumen en cambio de fase ($\Delta V$) y la temperatura absoluta ($T$) y se expresa como:
y la definici n de el calor latente molar ($l_m$), en la que el calor latente ($L$) est relacionado con la masa molar ($M_m$) de la siguiente manera:
y el variación del volumen molar en cambio de fase ($\Delta v_m$), en la que la variación de volumen en cambio de fase ($\Delta V$) est relacionado con la masa molar ($M_m$) de la siguiente manera:
se obtiene:
Si el diferencial de la energía libre de Gibbs ($dG$) es constante, esto significa que para la variación de la presión ($dp$) y la variación de la temperatura ($dT$), el valor de la entropía ($S$) y el volumen ($V$) en la fase 1
$dG = -S_1dT+V_1dp$
y la entropía ($S$) y el volumen ($V$) en la fase 2
$dG = -S_2dT+V_2dp$
resultan en
$\displaystyle\frac{dp}{dT}=\displaystyle\frac{S_2-S_1}{V_2-V_1}$
El cambio en la entropía ($S$) entre ambas fases corresponde a el calor latente ($L$) dividido por la temperatura absoluta ($T$):
$S_2 - S_1 =\displaystyle\frac{ L }{ T }$
Entonces, con la definici n de la variación de volumen en cambio de fase ($\Delta V$)
$\Delta V \equiv V_2 - V_1$
obtenemos
Ejemplos
La fase gaseosa, que en nuestro caso corresponde al vapor de agua, es aquella en la que los tomos pueden desplazarse relativamente libremente.
En esta fase, existe una interacci n m nima que puede afectar el comportamiento de los tomos sin confinarlos de manera significativa.
La fase l quida, que en nuestro caso corresponde al agua, es aquella en la que los tomos pueden desplazarse relativa y libremente, manteniendo su unidad pero adapt ndose a la forma que los contiene.
En esta fase, no se observa ninguna estructura definida.
La fase s lida, que en nuestro caso corresponde al hielo, es aquella en la que los tomos no pueden desplazarse relativamente y solo pueden oscilar en torno a su punto de equilibrio.
En esta fase, se puede observar una estructura que suele ser cristalina y, por lo tanto, regular.
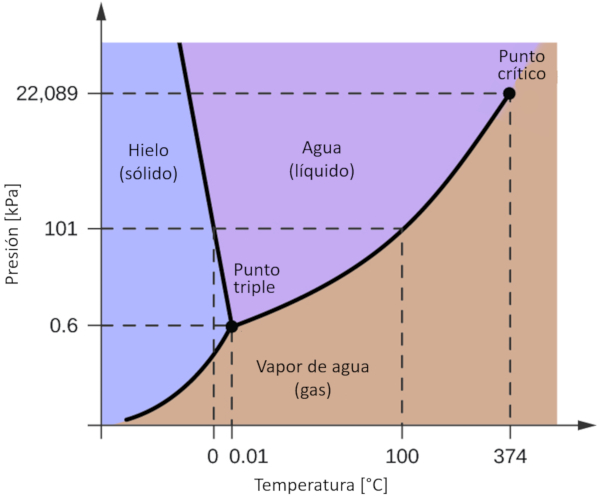
Uno de los diagramas de fase m s significativos para nuestro planeta es el del agua. Este diagrama presenta las tres fases cl sicas: s lido, l quido y gas, adem s de una variedad de fases con diferentes estructuras cristalinas del hielo.
La caracter stica m s destacada en comparaci n con otros materiales es que en un rango de presi n comprendido entre 611 Pa y 209.9 MPa, el estado s lido ocupa un volumen mayor que el estado l quido. Este fen meno se refleja en el diagrama de fase como una pendiente negativa en la l nea que separa las fases s lidas (hielo con estructura hexagonal) y l quidas (agua).
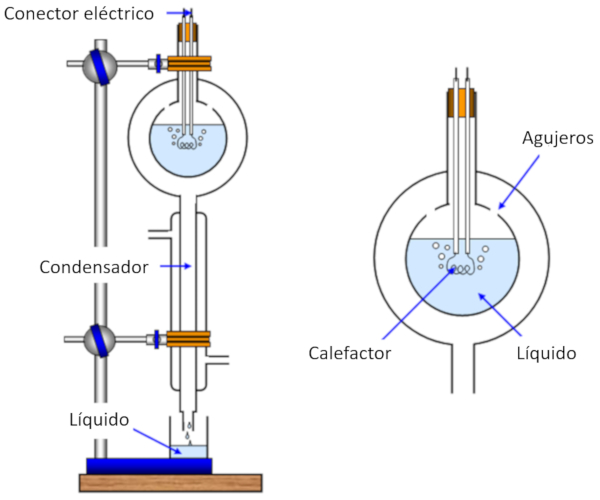
La medici n del calor de evaporaci n se realiza calentando una muestra, lo que provoca su evaporaci n, mientras se registra la cantidad de calor suministrada a la muestra. Luego, se enfr a el vapor generado y se lo hace condensar, midiendo la masa originalmente evaporada.
De esta manera, podemos calcular la energ a necesaria para evaporar una masa determinada, lo que se expresa como ERROR:5238,0 y se mide en julios por kilogramo (J/kg) o julios por mol (J/mol).
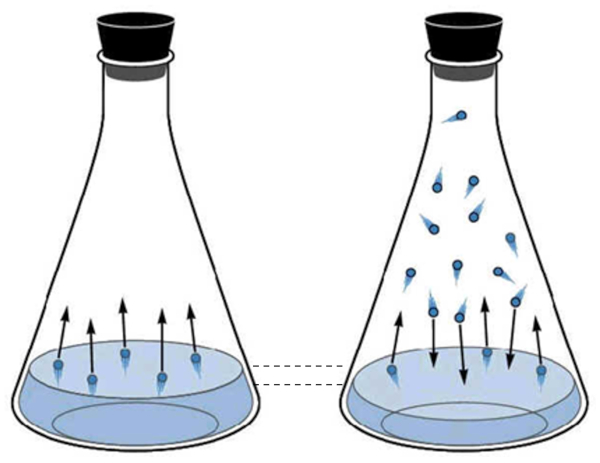
La fase gaseosa del agua corresponde a lo que se denomina el vapor de agua. Esta se crea cuando las mol culas de agua adquieren suficiente energ a cin tica para escapar de la fase l quida y comienzan a moverse en el espacio sobre el l quido. Peri dicamente, las mol culas en estado gaseoso chocan nuevamente contra la superficie del l quido y son capturadas, volviendo al estado l quido.
A medida que aumenta el n mero de mol culas en estado gaseoso, tambi n aumenta el n mero de mol culas que regresan al estado l quido. Este proceso contin a hasta que se alcanza un equilibrio entre las mol culas que abandonan el l quido y las que son reabsorbidas. En esta situaci n, se dice que el espacio sobre el l quido est saturado.
El diferencial de la energía interna ($dU$) siempre es igual a la cantidad de el diferencial inexacto del calor ($\delta Q$) suministrada al sistema (positiva) menos la cantidad de el diferencial inexacto del trabajo ($\delta W$) realizada por el sistema (negativa):
En analog a con la definici n del trabajo $dW$ en la mec nica:
que se define en funci n de la fuerza $F$ y el desplazamiento $dx$, en termodin mica se trabaja con la expresi n del trabajo en funci n de la presi n $p$ y la variaci n de volumen $dV$:
El diferencial inexacto del calor ($\delta Q$) es igual a la temperatura absoluta ($T$) por la variación de la entropía ($dS$):
La dependencia de el diferencial de la energía interna ($dU$) de la presión ($p$) y la variación del volumen ($\Delta V$), adem s de la temperatura absoluta ($T$) y la variación de la entropía ($dS$), est dada por:
La entalpía ($H$) se define como la suma de la energía interna ($U$) y la energ a de formaci n. Esta ltima corresponde al trabajo realizado en la formaci n, que es igual a $pV$ con la presión ($p$) y el volumen ($V$). Por lo tanto, obtenemos:
La dependencia de el diferencial de la entalpía ($dH$) de la temperatura absoluta ($T$) y la variación de la entropía ($dS$), adem s de el volumen ($V$) y la variación de la presión ($dp$), est dada por:
La dependencia de la variación de la Energía Libre de Gibbs ($dG$) de la entropía ($S$) y la variación de la temperatura ($dT$), adem s de el volumen ($V$) y la variación de la presión ($dp$), est dada por:
La ley de Clausius-Clapeyron establece una relaci n entre la variación de la presión ($dp$) y la variación de la temperatura ($dT$) con el calor latente ($L$), la temperatura absoluta ($T$) y la variación de volumen en cambio de fase ($\Delta V$) de la siguiente manera:
En muchas ocasiones, no se dispone del calor latente molar, sino del calor latente que se expresa, por ejemplo, en Joules por kilogramo (J/kg). Dado que la ecuaci n de presi n de vapor trabaja con el calor latente molar, es necesario convertir el calor latente en calor latente molar. Como este ltimo se refiere a la cantidad por mol, simplemente dividimos el calor latente ($L$) por la masa molar ($M_m$) para obtener el calor latente molar ($l_m$):
En el caso del agua, el calor latente de evaporaci n es del orden de $L\sim 2.256\times 10^6 J/kg$, mientras que la masa molar es $M_m\sim 18 g/cm^3 = 0.018 kg/m^3$. De esta manera, obtenemos un calor latente molar de $L_m\sim 40600 J/mol = 40.6 kJ/mol$.
La ecuaci n de Clausius-Clapeyron establece una relaci n entre la variación de la presión ($dp$) y la variación de la temperatura ($dT$) con la temperatura absoluta ($T$), el calor latente molar ($l_m$) y el variación del volumen molar en cambio de fase ($\Delta v_m$) de la siguiente manera:
La variación de volumen en cambio de fase ($\Delta V$), al cambiar de fase de un l quido a un gas, se puede expresar como:
$\Delta V = V_{\text{gas}} - V_{\text{l quido}}$
Dado que el volumen del gas es significativamente mayor que el del l quido,
$V_{\text{gas}} \gg V_{\text{l quido}}$
podemos aproximar:
$\Delta V \approx V_{\text{gas}}$
Debido a que el vapor de agua exhibe un comportamiento similar al de un gas ideal, podemos afirmar que con los valores de la constante universal de los gases ($R_C$), el número de moles ($n$), la temperatura absoluta ($T$) y la presión de vapor de agua no saturado ($p_v$):
por lo que la variación de volumen en cambio de fase ($\Delta V$) es
$\Delta V = \displaystyle\frac{nRT}{p_v}$
La presión de vapor de agua saturado ($p_s$) se puede calcular utilizando la presión de referencia ($p_{ref}$), la constante universal de los gases ($R_C$), la temperatura absoluta ($T$) y el calor latente molar ($l_m$) de acuerdo con la siguiente f rmula:
La relaci n entre la concentración de moleculas de vapor de agua ($c_v$) y ERROR:4952,0 se llama la humedad relativa ($RH$). En otras palabras, cuando se alcanza una humedad relativa del 100%, la concentraci n existente ser igual a la concentraci n saturada.
La presión ($p$) se puede calcular a partir de la concentración molar ($c_m$) utilizando la temperatura absoluta ($T$) y la constante universal de los gases ($R_C$) de la siguiente manera:
La humedad relativa ($RH$) se puede expresar en t rminos de la presión de vapor de agua no saturado ($p_v$) y la presión de vapor de agua saturado ($p_s$) de la siguiente manera:
ID:(377, 0)