Fase gasosa, vapor de água
Conceito 
A fase gasosa, que no nosso caso corresponde ao vapor de água, é aquela em que os átomos podem se deslocar relativamente livremente.
Nesta fase, existe apenas uma interação mínima que pode afetar o comportamento dos átomos sem confiná-los significativamente.
ID:(15142, 0)
Fase líquida, água
Conceito 
A fase líquida, que no nosso caso corresponde à água, é aquela em que os átomos podem mover-se relativamente livremente, mantendo a sua unidade e adaptando-se à forma que os contém.

Nesta fase, não se observa nenhuma estrutura específica
ID:(15140, 0)
Fase sólida, gelo
Conceito 
A fase sólida, que no nosso caso corresponde ao gelo, é aquela em que os átomos não podem se deslocar relativamente, podendo apenas oscilar em torno de seu ponto de equilíbrio.

Nesta fase, pode-se observar uma estrutura que costuma ser cristalina e, portanto, regular.
ID:(15141, 0)
Diagrama de fase da água
Conceito 
Um dos diagramas de fase mais relevantes para o nosso planeta é o da água. Este diagrama apresenta as três fases clássicas: sólida, líquida e gasosa, além de várias fases com diferentes estruturas cristalinas do gelo.
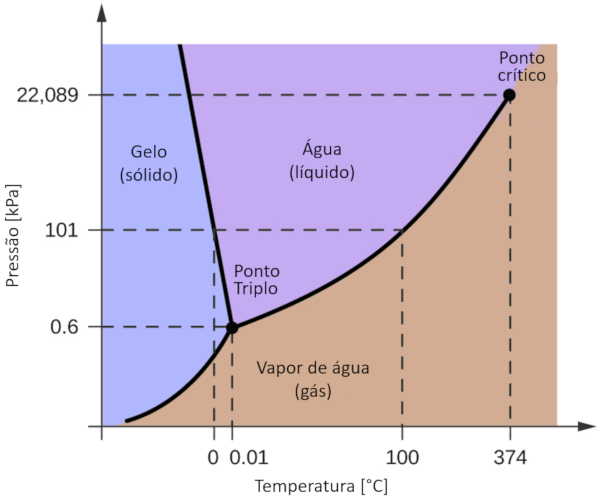
A diferença significativa em relação a outros materiais é que, dentro de uma faixa de pressão que varia de 611 Pa a 209,9 MPa, o estado sólido ocupa um volume maior do que o estado líquido. Essa característica é refletida no diagrama de fase como uma inclinação negativa ao longo da linha de separação entre o estado sólido (gelo hexagonal) e o estado líquido (água).
Esse fenômeno pode ser explicado pela equação de Clausius-Clapeyron:
Neste caso, mostra uma variação negativa no volume:
$\Delta v=v_{água}-v_{gelo}= 18,015,ml/mol-19,645,ml/mol=-1,63,ml/mol<0$
Essa propriedade leva a situações em que, devido à falta de espaço para expansão, a água não congela, preservando a vida contida nela. Por outro lado, a pressão gerada pelo fato de o gelo ocupar mais volume é um dos principais mecanismos de erosão na Terra.
ID:(836, 0)
Medição de calor por evaporação
Conceito 
A medição do calor de vaporização é realizada aquecendo uma amostra, o que a faz evaporar, enquanto simultaneamente se mede o calor entregue à amostra. Em seguida, o vapor é resfriado e condensado, e a massa que originalmente evaporou é medida.
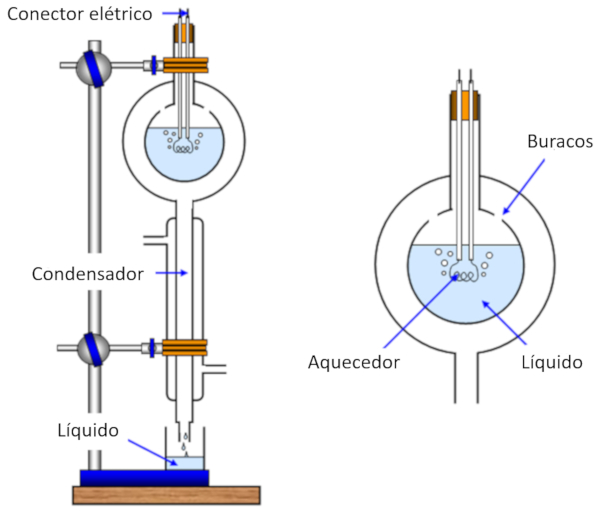
Dessa forma, podemos estimar a energia necessária para vaporizar uma massa específica, o que corresponde a calor latente ($L$) medido em joules por quilograma (J/kg) ou joules por mol (J/mol).
ID:(1662, 0)
Vapor de água
Conceito 
A fase gasosa da água corresponde ao que é conhecido como vapor de água. Ela é criada quando as moléculas de água adquirem energia cinética suficiente para escapar da fase líquida e começam a se mover pelo espaço acima do líquido. Periodicamente, as moléculas em estado gasoso colidem novamente com a superfície líquida e são capturadas, retornando ao estado líquido.
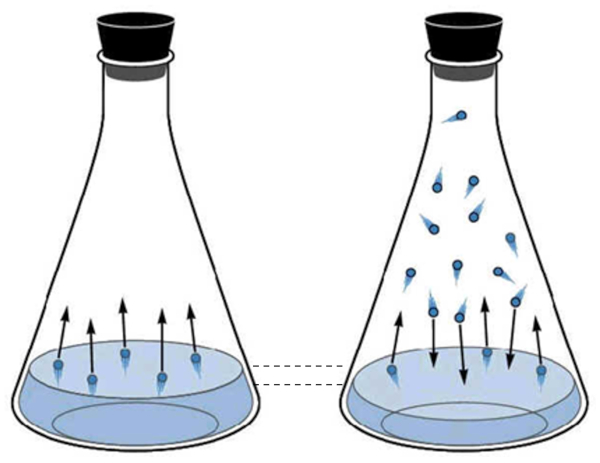
À medida que o número de moléculas em estado gasoso aumenta, também aumenta o número de moléculas que retornam ao estado líquido. Esse processo continua até que um equilíbrio seja alcançado entre as moléculas que deixam o líquido e as que são reabsorvidas. Nessa situação, diz-se que o espaço acima do líquido está saturado.
ID:(1010, 0)
Modelo
Conceito 
Variáveis
Parâmetros
Parâmetro selecionado
Cálculos
Equação
$ dG =- S dT + V dp $
dG =- S * dT + V * dp
$ dH = T dS + V dp $
dH = T * dS + V * dp
$\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$
dp / dT = L /( DV * T )
$\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T }$
dp / dT = l_m /( Dv_m * T )
$ \delta Q = T dS $
dQ = T * dS
$ dU = \delta Q - \delta W $
dU = dQ - dW
$ dU = T dS - p dV $
dU = T * dS - p * dV
$ \Delta V =\displaystyle\frac{ n R T }{ p_v }$
DV = n * R * T / p_v
$ \delta W = p dV $
dW = p * dV
$ H = U + p V $
H = U + p * V
$ l_m \equiv\displaystyle\frac{ L }{ M_m }$
l_m = L / M_m
$ p = c_m R T $
p = c_m * R * T
$ p_s = p_{ref} e^{- l_m / R T }$
p_s = p_ref *exp(- l_m / R * T )
$ RH =\displaystyle\frac{ c_v }{ c_s }$
RH = c_v / c_s
$ RH =\displaystyle\frac{ p_v }{ p_s }$
RH = p_v / p_s
ID:(15231, 0)
Primeira Lei da Termodinâmica
Equação 
A primeira lei da termodinâmica estabelece que a energia se conserva, ou seja, que o diferencial de energia interna ($dU$) é sempre igual a o diferencial de calor impreciso ($\delta Q$) fornecido ao sistema (positivo) menos o diferencial de trabalho impreciso ($\delta W$) realizado pelo sistema (negativo).
Portanto, temos:
Enquanto o diferencial exato não depende de como a variação é executada, o diferencial inexato depende. Quando nos referimos a um diferencial sem especificar que é inexato, assume-se que ele é exato.
ID:(9632, 0)
Trabalhe dependendo do volume
Equação 
Analogamente à definição do trabalho $dW$ na mecânica:
| $ \delta W = F dx $ |
que é definido em termos da força $F$ e do deslocamento $dx$, na termodinâmica, trabalhamos com a expressão do trabalho em função da pressão $p$ e da variação de volume $dV$:
ID:(9634, 0)
Segunda lei da termodinâmica
Equação 
A segunda lei da termodinâmica afirma que não é possível converter completamente a energia o diferencial de energia interna ($dU$) em trabalho útil o diferencial de trabalho impreciso ($\delta W$). A diferença entre essas quantidades está relacionada à energia não utilizada o diferencial de calor impreciso ($\delta Q$), que corresponde ao calor gerado ou absorvido no processo la temperatura absoluta ($T$).
No caso de o diferencial de trabalho impreciso ($\delta W$), existe uma relação entre a variável intensiva la pressão ($p$) e a variável extensiva o volume ($V$), expressa da seguinte forma:
| $ \delta W = p dV $ |
Uma variável intensiva é caracterizada por definir o estado do sistema e não depender do seu tamanho. Nesse sentido, la pressão ($p$) é uma variável intensiva, pois descreve o estado de um sistema independentemente do seu tamanho. Por outro lado, uma variável extensiva, como o volume ($V$), aumenta com o tamanho do sistema.
No caso de o diferencial de calor impreciso ($\delta Q$), é necessária uma variável extensiva adicional, denominada la entropia ($S$), para complementar a variável intensiva la temperatura absoluta ($T$) e definir a relação da seguinte forma:
Essa nova variável, que chamaremos de la entropia ($S$), é apresentada aqui em sua forma diferencial (la variação de entropia ($dS$)) e modela o efeito de que nem toda a energia o diferencial de energia interna ($dU$) pode ser totalmente convertida em trabalho útil o diferencial de trabalho impreciso ($\delta W$).
ID:(9639, 0)
Energia Interna: Razão Diferencial
Equação 
Como o diferencial de energia interna ($dU$) depende de o diferencial de calor impreciso ($\delta Q$), la pressão ($p$) e la variação de volume ($dV$) de acordo com a equação:
| $ dU = \delta Q - p dV $ |
podemos substituir o diferencial de calor impreciso ($\delta Q$) pela expressão da segunda lei da termodinâmica em termos de la temperatura absoluta ($T$) e la variação de entropia ($dS$), resultando na expressão para o diferencial de energia interna ($dU$):
Uma vez que o diferencial de energia interna ($dU$) depende de o diferencial de calor impreciso ($\delta Q$), la pressão ($p$), e la variação de volume ($dV$) de acordo com a equação:
| $ dU = \delta Q - p dV $ |
e a expressão da segunda lei da termodinâmica com la temperatura absoluta ($T$) e la variação de entropia ($dS$) como:
| $ \delta Q = T dS $ |
podemos concluir que:
| $ dU = T dS - p dV $ |
ID:(3471, 0)
Entalpia $H(S,p)$
Equação 
Se precisarmos levar em consideração a energia necessária para formar o sistema, além da energia interna, devemos considerar la entalpia ($H$).
la entalpia ($H$) [1] é definido como a soma de la energia interna ($U$) e a energia de formação. Esta última corresponde ao trabalho realizado na formação, que é igual a $pV$ com la pressão ($p$) e o volume ($V$).
Portanto, temos:
la entalpia ($H$) é uma função de la entropia ($S$) e la pressão ($p$).
Um artigo que pode ser considerado como o ponto de partida do conceito, embora não inclua a definição do nome, é:
[1] "Memoir on the Motive Power of Heat, Especially as Regards Steam, and on the Mechanical Equivalent of Heat" (Memória sobre o poder motriz do calor, especialmente no que se refere ao vapor, e sobre o equivalente mecânico do calor), escrito por Benoît Paul Émile Clapeyron (1834).
ID:(3536, 0)
Relação de entalpia diferencial
Equação 
Uma vez que la entalpia ($H$) é uma função de la energia interna ($U$), la pressão ($p$) e o volume ($V$) de acordo com a equação:
| $ H = U + p V $ |
e esta equação depende apenas de la entropia ($S$) e la pressão ($p$), podemos mostrar que sua derivada parcial em relação a o diferencial de entalpia ($dH$) é igual a:
Ao diferenciar a função da entalpia:
| $ H = U + p V $ |
obtemos:
$dH = dU + Vdp + pdV$
Com o diferencial da energia interna:
| $ dU = T dS - p dV $ |
podemos concluir:
| $ dH = T dS + V dp $ |
onde também são considerados la variação de entropia ($dS$), la variação de pressão ($dp$) e la temperatura absoluta ($T$).
ID:(3473, 0)
Energia livre de Gibbs como diferencial
Equação 
Como la energia livre de Gibbs ($G$) [1,2] depende de la entalpia ($H$), la entropia ($S$) e la temperatura absoluta ($T$):
| $ G = H - T S $ |
A dependência de la energia livre de Gibbs ($G$) com relação a la pressão ($p$) é obtida, e a partir de la temperatura absoluta ($T$), obtemos o diferencial:
La energia livre de Gibbs ($G$) em função de la entalpia ($H$), la entropia ($S$) e la temperatura absoluta ($T$) é expresso da seguinte forma:
| $ G = H - T S $ |
O valor de o diferencial de energia livre de Gibbs ($dG$) é determinado usando o diferencial de entalpia ($dH$), la variação de temperatura ($dT$) e la variação de entropia ($dS$) através da equação:
$dG=dH-SdT-TdS$
Uma vez que o diferencial de entalpia ($dH$) está relacionado com o volume ($V$) e la variação de pressão ($dp$) da seguinte forma:
| $ dH = T dS + V dp $ |
Segue-se que o diferencial de entalpia ($dH$), la variação de entropia ($dS$) e la variação de pressão ($dp$) estão interligados da seguinte maneira:
| $ dG =- S dT + V dp $ |
[1] "On the Equilibrium of Heterogeneous Substances" (Sobre o Equilíbrio de Substâncias Heterogêneas), J. Willard Gibbs, Transactions of the Connecticut Academy of Arts and Sciences. 3: 108-248. (Outubro de 1875 Maio de 1876)
[2] "On the Equilibrium of Heterogeneous Substances" (Sobre o Equilíbrio de Substâncias Heterogêneas), J. Willard Gibbs, Transactions of the Connecticut Academy of Arts and Sciences. 3: 343-524. (Maio de 1877 Julho de 1878)
ID:(3541, 0)
Lei de Clausius Clapeyron
Equação 
O diferencial de energia livre de Gibbs ($dG$) pode ser calculado usando la variação de pressão ($dp$) e la variação de temperatura ($dT$) em conjunto com la entropia ($S$) e o volume ($V$):
| $ dG =- S dT + V dp $ |
Esta equação permanece constante ao longo das linhas que separam as fases durante uma mudança de fase. Isso nos permite demonstrar a Lei de Clausius-Clapeyron com a ajuda de o calor latente ($L$), la temperatura absoluta ($T$) e la variação de volume na mudança de fase ($\Delta V$) [1,2,3]:
Se o diferencial de energia livre de Gibbs ($dG$) é constante, significa que, para la variação de pressão ($dp$) e la variação de temperatura ($dT$), os valores de la entropia ($S$) e o volume ($V$) na fase 1
$dG = -S_1dT+V_1dp$
e la entropia ($S$) e o volume ($V$) na fase 2
$dG = -S_2dT+V_2dp$
resultam em
$\displaystyle\frac{dp}{dT}=\displaystyle\frac{S_2-S_1}{V_2-V_1}$
A mudança em la entropia ($S$) entre ambas as fases corresponde a o calor latente ($L$) dividido por la temperatura absoluta ($T$):
$S_2 - S_1 =\displaystyle\frac{ L }{ T }$
Assim, com a definição de la variação de volume na mudança de fase ($\Delta V$)
$\Delta V \equiv V_2 - V_1$
obtemos
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
[1] "Über die Art der Bewegung, welche wir Wärme nennen." (Sobre a Natureza do Movimento Chamado Calor), Rudolf Clausius, Annalen der Physik und Chemie, 155(6), 368-397. (1850)
[2] "Ueber eine veränderte Form des zweiten Hauptsatzes der mechanischen Wärmetheorie" (Sobre uma Forma Modificada da Segunda Lei da Teoria Mecânica do Calor), Rudolf Clausius, Annalen der Physik, 176(3), 353-400. (1857)
[3] "Mémoire sur la puissance motrice de la chaleur." (Memória sobre o Poder Motriz do Calor), Benoît Paul Émile Clapeyron, Journal de l'École Royale Polytechnique, 14, 153-190. (1834)
ID:(12824, 0)
Lei molar de Clausius Clapeyron
Equação 
A equação de Clausius-Clapeyron [1,2,3], que depende de la variação de pressão ($dp$), la variação de temperatura ($dT$), o calor latente ($L$), la variação de volume na mudança de fase ($\Delta V$) e la temperatura absoluta ($T$), é expressa da seguinte forma:
Esta equação pode ser reescrita em termos de o calor latente molar ($l_m$) e o variação do volume molar durante a mudança de fase ($\Delta v_m$) da seguinte maneira:
Com a lei de Clausius-Clapeyron, que depende de la variação de pressão ($dp$), la variação de temperatura ($dT$), o calor latente ($L$), la variação de volume na mudança de fase ($\Delta V$) e la temperatura absoluta ($T$), expressa como:
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
e a definição de o calor latente molar ($l_m$), onde o calor latente ($L$) está relacionado a la massa molar ($M_m$) da seguinte forma:
| $ l_m \equiv\displaystyle\frac{ L }{ M_m }$ |
e o variação do volume molar durante a mudança de fase ($\Delta v_m$), onde la variação de volume na mudança de fase ($\Delta V$) está relacionado a la massa molar ($M_m$) da seguinte forma:
| $\Delta v_m =\displaystyle\frac{ \Delta V }{ M_m }$ |
obtemos:
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T }$ |
[1] "Über die Art der Bewegung, welche wir Wärme nennen." (Sobre a Natureza do Movimento que Chamamos de Calor), Rudolf Clausius, Annalen der Physik und Chemie, 155(6), 368-397. (1850)
[2] "Über eine veränderte Form des zweiten Hauptsatzes der mechanischen Wärmetheorie" (Sobre uma Forma Modificada do Segundo Teorema Fundamental na Teoria Mecânica do Calor), Rudolf Clausius, Annalen der Physik, 176(3), 353-400. (1857)
[3] "Mémoire sur la puissance motrice de la chaleur." (Memória sobre o Poder Motriz do Calor), Benoît Paul Émile Clapeyron, Journal de l'École Royale Polytechnique, 14, 153-190. (1834)
ID:(12822, 0)
Quantidade de vapor de água
Equação 
Quando ocorre uma mudança de fase de um líquido para um gás, a alteração no volume pode ser expressa como:
$\Delta V = V_{\text{gás}} - V_{\text{líquido}}$
Dado que o volume do gás é muito maior do que o do líquido ( ($$)), podemos aproximá-lo como:
$\Delta V \approx V_{\text{gás}}$
Como o vapor de água apresenta um comportamento semelhante ao de um gás ideal, podemos afirmar que com os valores la constante de gás universal ($R$), o número de moles ($n$), la temperatura absoluta ($T$) e la pressão de vapor de água insaturada ($p_v$):
ID:(3185, 0)
Quantidade de vapor de água
Equação 
Usando a equação de Clausius-Clapeyron para o gradiente de la pressão ($p$) em relação a la temperatura absoluta ($T$), que depende de o calor latente molar ($l_m$) e o variação do volume molar durante a mudança de fase ($\Delta v_m$):
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T }$ |
e a lei dos gases ideais, podemos calcular a la pressão de vapor de água saturada ($p_s$) em relação a la pressão de referência ($p_{ref}$) e la constante de gás universal ($R$):
Usando a equação de Clausius-Clapeyron para o gradiente de la pressão ($p$) em relação a la temperatura absoluta ($T$), que depende de o calor latente ($L$) e la variação de volume na mudança de fase ($\Delta V$):
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
No caso da mudança de fase de líquido para gás, podemos assumir que a mudança de volume é aproximadamente igual ao volume do vapor. Portanto, podemos empregar a equação dos gases ideais com o número de moles ($n$), o volume ($V$), la constante de gás universal ($R$) e la pressão de vapor de água insaturada ($p_v$):
| $ \Delta V =\displaystyle\frac{ n R T }{ p_v }$ |
Uma vez que a equação de Clausius-Clapeyron pode ser escrita como:
$\displaystyle\frac{dp}{dT}=\displaystyle\frac{L}{n}\displaystyle\frac{p}{R T^2}$
Onde o calor latente molar ($l_m$) ($l_m = L/n$) corresponde à mudança de entalpia durante a mudança de fase h (a energia necessária para formar água), nós finalmente obtemos:
$\displaystyle\frac{dp}{dT}=l_m\displaystyle\frac{p}{RT^2}$
Se integramos esta equação entre la pressão de vapor de água saturada ($p_s$) e a pressão no ponto
$p_s=p_0e^{l_m/RT_0}e^{-l_m/RT}$
Se avaliarmos esta expressão com os dados no ponto crítico:
$p_{ref}=p_0e^{l_m/RT_0}$
Nós finalmente temos:
| $ p_s = p_{ref} e^{- l_m / R T }$ |
A La pressão de referência ($p_{ref}$) pode ser calculada utilizando dados tanto do ponto triplo quanto do ponto crítico. No primeiro caso, a temperatura é de 0,01°C = 273,16K, e a pressão é de 611,73 Pa. Se o calor latente molar for de 40,65 kJ/mol (para a água), então la pressão de referência ($p_{ref}$) tem um valor de 3,63E+10 Pa.
ID:(3182, 0)
Umidade relativa, concentração
Equação 
La relation entre la concentração de moléculas de vapor de água ($c_v$) et concentração de vapor de água saturado ($c_s$) est appelée la umidade relativa ($RH$). En d'autres termes, lorsque l'humidité relative atteint 100 %, la concentration existante est égale à la concentration saturée.
ID:(3175, 0)
Pressão em função da concentração molar
Equação 
Quando la pressão ($p$) se comporta como um gás ideal, cumprindo com o volume ($V$), o número de moles ($n$), la temperatura absoluta ($T$) e la constante de gás universal ($R$), a equação dos gases ideais:
| $ p V = n R T $ |
pode ser reescrita em termos de la concentração molar ($c_m$) como:
Quando la pressão ($p$) se comporta como um gás ideal, cumprindo com o volume ($V$), o número de moles ($n$), la temperatura absoluta ($T$) e la constante de gás universal ($R$), a equação dos gases ideais:
| $ p V = n R T $ |
e a definição de la concentração molar ($c_m$):
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
levam à seguinte relação:
| $ p = c_m R T $ |
ID:(4479, 0)
Umidade relativa, concentração
Equação 
A relação entre la concentração de moléculas de vapor de água ($c_v$) e concentração de vapor de água saturado ($c_s$) é chamada de la umidade relativa ($RH$):
| $ RH =\displaystyle\frac{ c_v }{ c_s }$ |
e pode ser expressa em termos de la pressão de vapor de água insaturada ($p_v$) e la pressão de vapor de água saturada ($p_s$) da seguinte forma:
A relação entre la umidade relativa ($RH$) com la concentração de moléculas de vapor de água ($c_v$) e concentração de vapor de água saturado ($c_s$) é expressa como:
| $ RH =\displaystyle\frac{ c_v }{ c_s }$ |
e relacionando la pressão ($p$) com la concentração molar ($c_m$), la temperatura absoluta ($T$) e la constante de gás universal ($R$), obtemos:
| $ p = c_m R T $ |
Isso se aplica à pressão de vapor de água, onde:
$p_v = c_v R T$
e à pressão de vapor saturada de água:
$p_s = c_s R T$
resultando na seguinte equação:
| $ RH =\displaystyle\frac{ p_v }{ p_s }$ |
ID:(4478, 0)
