Lei de Gay-Lussac
Storyboard 
A lei de Gay-Lussac estabelece que a divisão de la pressão ($p$) por la temperatura absoluta ($T$) permanece constante enquanto o volume e a quantidade de moles são mantidos constantes.
Isso significa que la pressão ($p$) varia de forma proporcional a la temperatura absoluta ($T$).
ID:(1474, 0)
Mecanismos
Definição 
A lei de Gay-Lussac estabelece que a pressão de um gás é diretamente proporcional à sua temperatura quando o volume é mantido constante. Isso significa que, à medida que a temperatura de um gás aumenta, sua pressão também aumenta, desde que o volume não mude. Inversamente, se a temperatura diminui, a pressão também diminui. Essa relação é crucial para entender o comportamento dos gases em recipientes fechados, onde um aumento na temperatura leva a um aumento na pressão, e uma diminuição na temperatura leva a uma diminuição na pressão.
ID:(15256, 0)
Variação de pressão e temperatura
Imagem 
La pressão ($p$) surge quando as partículas de gás colidem com a superfície do recipiente de gás. Cada colisão transmite um momento igual a duas vezes la massa molar ($m$) por la velocidade média de uma partícula ($\bar{v}$). Além disso, é importante considerar o fluxo de partículas em direção à superfície, o qual depende de la concentração de partículas ($c_n$) e também da velocidade com que se deslocam, representada por la velocidade média de uma partícula ($\bar{v}$). Assim,
$p \propto c_n v \cdot m v = c_n m v^2$
O fluxo de partículas e a transmissão de momento são ilustrados no gráfico abaixo:
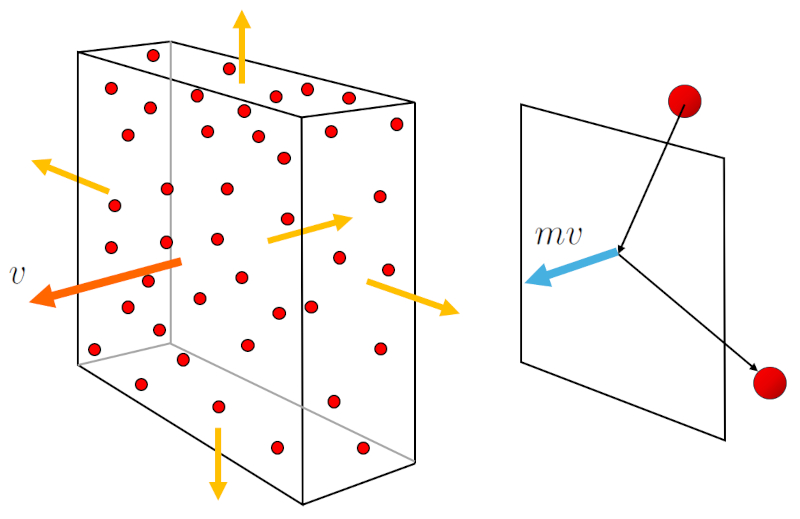
Além disso, la massa molar ($m$) por la velocidade média de uma partícula ($\bar{v}$) ao quadrado é proporcional a la energia de uma molécula ($E$), que por sua vez é proporcional a la temperatura absoluta ($T$):
$p \propto c_n mv^2 \propto E \propto T$
Nesse caso, quando o volume ($V$) e o número de partículas ($N$) são constantes, la concentração de partículas ($c_n$) também é constante.
ID:(15690, 0)
Relação temperatura x pressão
Nota 
Em um gás, quando se mantém constante o volume ($V$) e o número de partículas ($N$), observa-se que la pressão ($p$) e la temperatura absoluta ($T$) variam de forma proporcional. Quando la temperatura absoluta ($T$) diminui, la pressão ($p$) também diminui, e vice-versa,
$p \propto T$
como mostrado no seguinte gráfico:
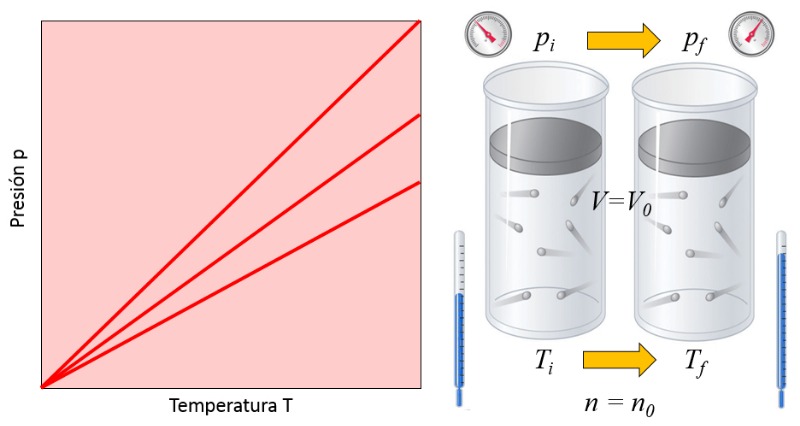
A lei de Gay-Lussac [1] afirma que quando ERROR:5226,0 e o número de partículas ($N$) são mantidos constantes, la pressão ($p$) e la temperatura absoluta ($T$) são diretamente proporcionais.
Isso é expresso com la constante da lei de Gay Lussac ($C_g$) da seguinte forma:
| $\displaystyle\frac{ p }{ T } = C_g$ |
![]() [1] "Mémoire sur la combinaison des substances gazeuses les unes avec les autres" (Memória sobre a combinação de substâncias gasosas entre si), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
[1] "Mémoire sur la combinaison des substances gazeuses les unes avec les autres" (Memória sobre a combinação de substâncias gasosas entre si), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
ID:(9530, 0)
Joseph Louis Gay Lussac
Citar 
Joseph Louis Gay-Lussac foi um químico e físico francês que viveu de 1778 a 1850. Ele fez contribuições significativas nos campos da química e das leis dos gases. Gay-Lussac realizou numerosos experimentos e investigações, especialmente sobre as propriedades dos gases, e formulou várias leis e princípios importantes. Uma de suas conquistas notáveis foi a descoberta da lei dos volumes combinados, conhecida como lei de Gay-Lussac. Ele também contribuiu para o estudo da eletrólise, a medição da temperatura e a compreensão das reações químicas. O trabalho de Gay-Lussac teve grande influência no desenvolvimento da química e estabeleceu as bases para as teorias químicas modernas.

ID:(1658, 0)
Mudança de estado de um gás ideal de acordo com a lei de Gay Lussac
Exercício 
A lei de Gay-Lussac estabelece que quando ERROR:5226,0 e o número de partículas ($N$) são mantidos constantes, a proporção de la pressão ($p$) para la temperatura absoluta ($T$) é igual a la constante da lei de Gay Lussac ($C_g$):
| $\displaystyle\frac{ p }{ T } = C_g$ |
Isso significa que se um gás transita de um estado inicial (la pressão no estado inicial ($p_i$) e la temperatura no estado inicial ($T_i$)) para um estado final (la pressão em estado final ($p_f$) e la temperatura no estado final ($T_f$)) mantendo la pressão ($p$) e o número de partículas ($N$) constantes, a lei de Gay-Lussac deve sempre ser obedecida:
$\displaystyle\frac{p_i}{T_i}=C_g=\displaystyle\frac{p_f}{T_f}$
Portanto, temos:
| $\displaystyle\frac{ p_i }{ T_i }=\displaystyle\frac{ p_f }{ T_f }$ |
ID:(15691, 0)
Lei de Gay-Lussac
Descrição 
A lei de Gay-Lussac estabelece que a divisão de 5224 por 5177 permanece constante enquanto o volume e a quantidade de moles são mantidos constantes. Isso significa que 5224 varia de forma proporcional a 5177.
Variáveis
Cálculos
Cálculos
Equações
A lei de Gay-Lussac estabelece que quando ERROR:5226,0 e o número de partículas ($N$) s o mantidos constantes, a propor o de la pressão ($p$) para la temperatura absoluta ($T$) igual a la constante da lei de Gay Lussac ($C_g$):
| $\displaystyle\frac{ p }{ T } = C_g$ |
Isso significa que se um g s transita de um estado inicial (la pressão no estado inicial ($p_i$) e la temperatura no estado inicial ($T_i$)) para um estado final (la pressão em estado final ($p_f$) e la temperatura no estado final ($T_f$)) mantendo la pressão ($p$) e o número de partículas ($N$) constantes, a lei de Gay-Lussac deve sempre ser obedecida:
$\displaystyle\frac{p_i}{T_i}=C_g=\displaystyle\frac{p_f}{T_f}$
Portanto, temos:
| $\displaystyle\frac{ p_i }{ T_i }=\displaystyle\frac{ p_f }{ T_f }$ |
(ID 3490)
Exemplos
A lei de Gay-Lussac estabelece que a press o de um g s diretamente proporcional sua temperatura quando o volume mantido constante. Isso significa que, medida que a temperatura de um g s aumenta, sua press o tamb m aumenta, desde que o volume n o mude. Inversamente, se a temperatura diminui, a press o tamb m diminui. Essa rela o crucial para entender o comportamento dos gases em recipientes fechados, onde um aumento na temperatura leva a um aumento na press o, e uma diminui o na temperatura leva a uma diminui o na press o.
(ID 15256)
La pressão ($p$) surge quando as part culas de g s colidem com a superf cie do recipiente de g s. Cada colis o transmite um momento igual a duas vezes la massa molar ($m$) por la velocidade média de uma partícula ($\bar{v}$). Al m disso, importante considerar o fluxo de part culas em dire o superf cie, o qual depende de la concentração de partículas ($c_n$) e tamb m da velocidade com que se deslocam, representada por la velocidade média de uma partícula ($\bar{v}$). Assim,
$p \propto c_n v \cdot m v = c_n m v^2$
O fluxo de part culas e a transmiss o de momento s o ilustrados no gr fico abaixo:

Al m disso, la massa molar ($m$) por la velocidade média de uma partícula ($\bar{v}$) ao quadrado proporcional a la energia de uma molécula ($E$), que por sua vez proporcional a la temperatura absoluta ($T$):
$p \propto c_n mv^2 \propto E \propto T$
Nesse caso, quando o volume ($V$) e o número de partículas ($N$) s o constantes, la concentração de partículas ($c_n$) tamb m constante.
(ID 15690)
Em um g s, quando se mant m constante o volume ($V$) e o número de partículas ($N$), observa-se que la pressão ($p$) e la temperatura absoluta ($T$) variam de forma proporcional. Quando la temperatura absoluta ($T$) diminui, la pressão ($p$) tamb m diminui, e vice-versa,
$p \propto T$
como mostrado no seguinte gr fico:

A lei de Gay-Lussac [1] afirma que quando ERROR:5226,0 e o número de partículas ($N$) s o mantidos constantes, la pressão ($p$) e la temperatura absoluta ($T$) s o diretamente proporcionais.
Isso expresso com la constante da lei de Gay Lussac ($C_g$) da seguinte forma:
| $\displaystyle\frac{ p }{ T } = C_g$ |
![]() [1] "M moire sur la combinaison des substances gazeuses les unes avec les autres" (Mem ria sobre a combina o de subst ncias gasosas entre si), Joseph Louis Gay-Lussac, Annales scientifiques de l' .N.S. 3e s rie, tome 3 (1886)
[1] "M moire sur la combinaison des substances gazeuses les unes avec les autres" (Mem ria sobre a combina o de subst ncias gasosas entre si), Joseph Louis Gay-Lussac, Annales scientifiques de l' .N.S. 3e s rie, tome 3 (1886)
(ID 9530)
Joseph Louis Gay-Lussac foi um qu mico e f sico franc s que viveu de 1778 a 1850. Ele fez contribui es significativas nos campos da qu mica e das leis dos gases. Gay-Lussac realizou numerosos experimentos e investiga es, especialmente sobre as propriedades dos gases, e formulou v rias leis e princ pios importantes. Uma de suas conquistas not veis foi a descoberta da lei dos volumes combinados, conhecida como lei de Gay-Lussac. Ele tamb m contribuiu para o estudo da eletr lise, a medi o da temperatura e a compreens o das rea es qu micas. O trabalho de Gay-Lussac teve grande influ ncia no desenvolvimento da qu mica e estabeleceu as bases para as teorias qu micas modernas.

(ID 1658)
A lei de Gay-Lussac estabelece que quando ERROR:5226,0 e o número de partículas ($N$) s o mantidos constantes, a propor o de la pressão ($p$) para la temperatura absoluta ($T$) igual a la constante da lei de Gay Lussac ($C_g$):
| $\displaystyle\frac{ p }{ T } = C_g$ |
Isso significa que se um g s transita de um estado inicial (la pressão no estado inicial ($p_i$) e la temperatura no estado inicial ($T_i$)) para um estado final (la pressão em estado final ($p_f$) e la temperatura no estado final ($T_f$)) mantendo la pressão ($p$) e o número de partículas ($N$) constantes, a lei de Gay-Lussac deve sempre ser obedecida:
$\displaystyle\frac{p_i}{T_i}=C_g=\displaystyle\frac{p_f}{T_f}$
Portanto, temos:
| $\displaystyle\frac{ p_i }{ T_i }=\displaystyle\frac{ p_f }{ T_f }$ |
(ID 15691)
(ID 15315)
A lei de Gay-Lussac [1] afirma que quando ERROR:5226,0 e o número de partículas ($N$) s o mantidos constantes, la pressão ($p$) e la temperatura absoluta ($T$) s o diretamente proporcionais.
Isso expresso com la constante da lei de Gay Lussac ($C_g$) da seguinte forma:
| $\displaystyle\frac{ p }{ T } = C_g$ |
[1] "M moire sur la combinaison des substances gazeuses les unes avec les autres" (Mem ria sobre a combina o de subst ncias gasosas entre si), Joseph Louis Gay-Lussac, Annales scientifiques de l' .N.S. 3e s rie, tome 3 (1886)
(ID 581)
A lei de Gay-Lussac [1] afirma que quando ERROR:5226,0 e o número de partículas ($N$) s o mantidos constantes, la pressão ($p$) e la temperatura absoluta ($T$) s o diretamente proporcionais.
Isso expresso com la constante da lei de Gay Lussac ($C_g$) da seguinte forma:
| $\displaystyle\frac{ p }{ T } = C_g$ |
[1] "M moire sur la combinaison des substances gazeuses les unes avec les autres" (Mem ria sobre a combina o de subst ncias gasosas entre si), Joseph Louis Gay-Lussac, Annales scientifiques de l' .N.S. 3e s rie, tome 3 (1886)
(ID 581)
Se um g s passa de um estado inicial (i) para um estado final (f) com la pressão ($p$) e o número de partículas ($N$) constantes, ent o para la pressão no estado inicial ($p_i$), la pressão em estado final ($p_f$), la temperatura no estado inicial ($T_i$) e la temperatura no estado final ($T_f$) v lido:
| $\displaystyle\frac{ p_i }{ T_i }=\displaystyle\frac{ p_f }{ T_f }$ |
(ID 3490)
ID:(1474, 0)
