Température et chaleur
Storyboard 
La température du sol dépend de sa capacité thermique et des échanges de chaleur vers ou depuis la surface du sol. La capacité thermique est influencée par la composition du sol et la quantité d'eau et de vapeur d'eau qu'il contient.
ID:(2052, 0)
Température et chaleur
Storyboard 
La température du sol dépend de sa capacité thermique et des échanges de chaleur vers ou depuis la surface du sol. La capacité thermique est influencée par la composition du sol et la quantité d'eau et de vapeur d'eau qu'il contient.
Variables
Calculs
Calculs
Équations
A chaleur fournie au liquide ou au solide ($\Delta Q$) est li a variation de température ($\Delta T$) et a capacité calorique ($C$) comme suit :
O A capacité calorique ($C$) peut tre remplac par le chaleur spécifique ($c$) et a masse ($M$) en utilisant la relation suivante :
Par cons quent, nous obtenons :
Avec a i-ième masse du système ($M_i$) et le chaleur spécifique de la ième masse ($c_i$), vous pouvez calculer le chaleur spécifique ($c$) pour le sol en utilisant l' quation suivante :
De plus, en utilisant les variables a masse sèche de sable dans l'échantillon ($M_a$), a masse sèche de limon dans l'échantillon ($M_i$), a masse sèche d'argile dans l'échantillon ($M_c$) et a masse d'eau dans le sol ($M_w$), ainsi que le chaleur spécifique du sable ($c_a$), le chaleur spécifique du limon ($c_i$), le chaleur spécifique de l'argile ($c_c$) et le chaleur spécifique de l'eau ($c_w$), vous pouvez obtenir la chaleur sp cifique (
$c$
) avec la formule suivante :
$c=\displaystyle\frac{M_ac_a+M_ic_i+M_cc_c+M_wc_w}{M_a+M_i+M_c+M_w}$
En utilisant les quations suivantes :
et
Ensuite, le chaleur spécifique ($c$) est simplifi l'aide de l' quation suivante :
La quantit de a capacité calorique ($C$) dans un syst me de a i-ième masse du système ($M_i$) avec le chaleur spécifique de la ième masse ($c_i$) peut tre calcul e comme suit :
$C = \displaystyle\sum_i c_i M_i$
o la somme des masses est obtenue comme suit :
$M = \displaystyle\sum_i M_i$
Ainsi, avec l'aide de l' quation
nous pouvons calculer a capacité calorique ($C$) comme suit :
Exemples
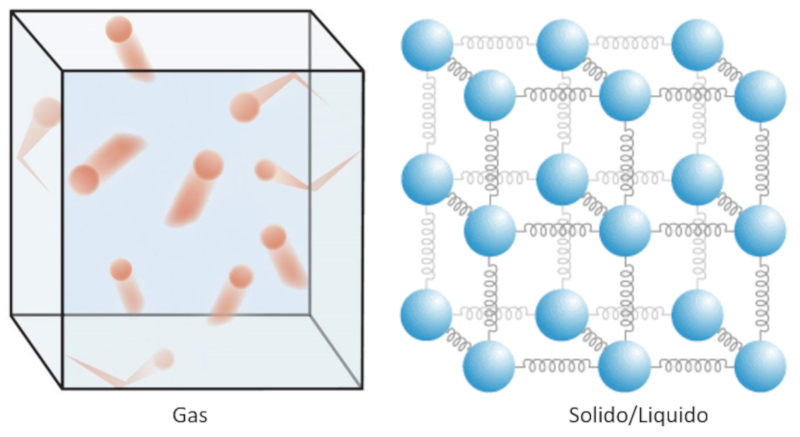
La chaleur n'est rien d\'autre qu\'une nergie l\' chelle microscopique.
Dans le cas d\'un gaz, cela correspond principalement l\' nergie cin tique de ses mol cules.
Dans les liquides et les solides, il faut tenir compte de l\'attraction entre les atomes, ce qui fait intervenir l\' nergie potentielle. Ainsi, dans ce cas, la chaleur correspond l\' nergie que les particules poss dent et avec laquelle elles oscillent autour du point d\' quilibre d fini par les autres particules de leur environnement.
La temp rature est le param tre que nous utilisons pour mesurer l' nergie thermique contenue dans un objet. tant donn que l' nergie thermique ne peut jamais tre n gative, il est essentiel de travailler avec l' chelle Kelvin, o son point z ro correspond l'absence totale de cette nergie.
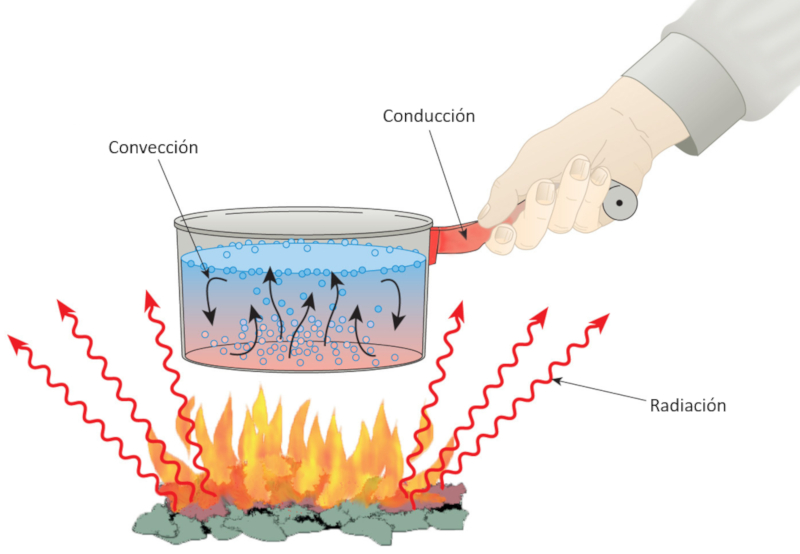
La chaleur est associ e des l ments tels que le feu, qui l ve la temp rature de l'eau. Le processus de chauffage g n re du mouvement, ce qui montre que la chaleur est li e l\' nergie m canique. M me la poign e d\'une casserole se r chauffe et notre corps est capable de percevoir cette temp rature. De plus, le feu met galement des rayonnements qui r chauffent les objets qu\'ils touchent.
Nous pouvons ainsi d duire qu\'en fournissant de la chaleur, nous pouvons augmenter la temp rature d\'un objet, et que la g n ration de mouvement est associ e l\' nergie.
Si un corps poss de initialement une quantit de chaleur le chaleur initiale ($Q_i$) et poss de ensuite une quantit de chaleur le chaleur finale ($Q_f$) ($Q_f > Q_i$), cela signifie que de la chaleur a t transf r e vers le corps le différence de chaleur ($\Delta Q$). En revanche, si ($Q_f < Q_i$), le corps a c d de la chaleur.
Si un syst me est initialement une température à l'état initial ($T_i$) et qu'il se trouve ensuite a température à l'état final ($T_f$), la diff rence sera de :
La diff rence de temp rature est ind pendante de savoir si ces valeurs sont en degr s Celsius ou en Kelvin.
Lorsque a chaleur fournie au liquide ou au solide ($\Delta Q$) sont ajout s un corps, nous observons une augmentation proportionnelle de a variation de température ($\Delta T$). Par cons quent, nous pouvons introduire une constante de proportionnalit a capacité calorique ($C$), appel e capacit thermique, qui tablit la relation suivante:
La capacit thermique est li e aux oscillations microscopiques, elle d pend donc moins de la masse et davantage du nombre d'atomes. C'est pourquoi il est logique d'introduire le concept de le chaleur spécifique ($c$), qui se calcule comme a capacité calorique ($C$) par unit de a masse ($M$), de la mani re suivante:
A chaleur fournie au liquide ou au solide ($\Delta Q$) peut tre calcul avec le chaleur spécifique ($c$), a masse ($M$) et a variation de température ($\Delta T$) en utilisantxa0:
La quantit de a capacité calorique ($C$) dans un syst me de a i-ième masse du système ($M_i$) avec le chaleur spécifique de la ième masse ($c_i$) peut tre calcul e comme suit :
$C = \displaystyle\sum_i c_i M_i$
Ainsi, la somme totale pour le chaleur spécifique ($c$) calcul e est :
La capacit thermique du sol d pend des variables a masse sèche de sable dans l'échantillon ($M_a$), a masse sèche de limon dans l'échantillon ($M_i$), et a masse sèche d'argile dans l'échantillon ($M_c$), en plus de a masse d'eau dans le sol ($M_w$). En collaboration avec le chaleur spécifique du sable ($c_a$), le chaleur spécifique du limon ($c_i$), le chaleur spécifique de l'argile ($c_c$), et le chaleur spécifique de l'eau ($c_w$), ces variables permettent le calcul de la capacit thermique sp cifique du sol. En particulier, nous pouvons travailler avec les proportions a fraction massique de sable dans l'échantillon ($g_a$), a fraction massique de limon dans l'échantillon ($g_i$), a fraction massique d'argile dans l'échantillon ($g_c$), et a propriété de porosité de l'argile ($\theta_w$) et d montrer que :
La capacit thermique d pend principalement de la teneur en eau, mais aussi de la texture et, par cons quent, de la proportion de sable, de limon et d'argile dans le sol. Dans tous les cas, les capacit s thermiques sp cifiques des diff rentes composantes sont les suivantes :
| Composante | $c$ [J/kg K] |
| Sable | 830 |
| Limon | 1350 |
| Argile | 1350 |
| Eau | 4184 |
ID:(2052, 0)