Práctico de Calorimetría
Storyboard 
Para determinar la capacidad calórica o el calor específico de un metal, se sumerge primero el metal en agua hirviendo y luego en agua a temperatura ambiente. A partir de la masa del agua y las variaciones de temperatura observadas, es posible calcular las propiedades térmicas del metal.
ID:(1315, 0)
Mecanismos
Definición 
La calorimetría es la práctica de medir el calor involucrado en reacciones químicas, cambios físicos o capacidad calorífica utilizando un calorímetro. En este proceso, se prepara un recipiente bien aislado para minimizar el intercambio de calor con el entorno, y se coloca dentro la sustancia o reacción de interés. Una vez que comienza la reacción o proceso, el calorímetro se sella para asegurar que no haya influencias externas de calor en la medición. Los cambios de temperatura se monitorean cuidadosamente con un termómetro o sensor de temperatura, y se registran la masa y la capacidad calorífica específica de las sustancias involucradas. El calor absorbido o liberado por la sustancia se calcula en función de los cambios de temperatura observados.
Existen diferentes tipos de calorimetría, como la calorimetría a presión constante, la calorimetría de bomba y la calorimetría diferencial de barrido (DSC), cada una adecuada para tipos específicos de reacciones y mediciones. Las aplicaciones de la calorimetría incluyen la determinación de los cambios de entalpía en reacciones químicas, la medición de capacidades caloríficas y transiciones de fase, el estudio de las tasas metabólicas en sistemas biológicos y la caracterización de materiales por sus propiedades térmicas.
En esencia, la calorimetría implica preparar el montaje experimental, iniciar el proceso, medir los cambios de temperatura con precisión y calcular la transferencia de calor para analizar las propiedades térmicas y comportamientos de diversas sustancias y reacciones.
ID:(15248, 0)
Experimento: diagrama envase y muestra
Imagen 
Calorímetro con carcasa aislante que contiene un termómetro y una muestra sumergida en agua. Junto a él, se encuentra un calorímetro metálico profesional.
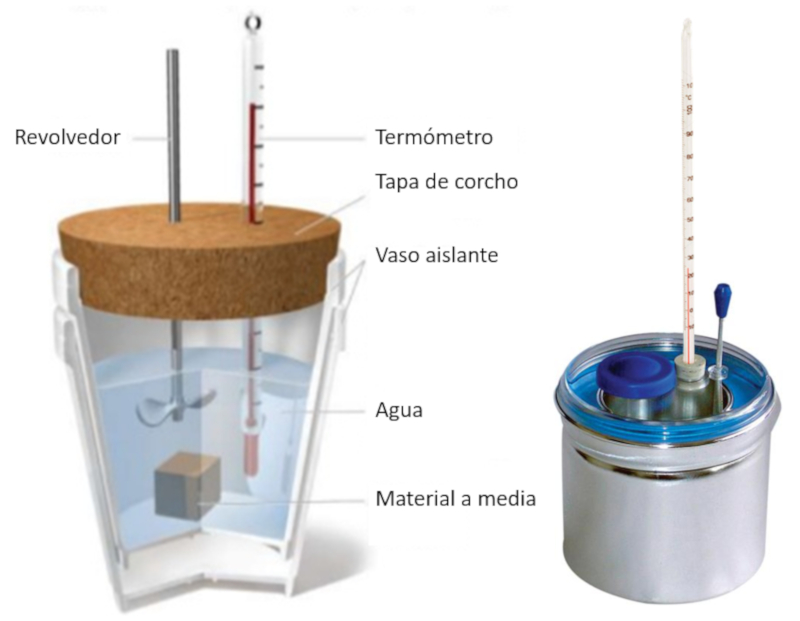
ID:(11120, 0)
Experimento: procedimiento calorimetria
Nota 
Pasos para realizar la medición:
Calentar una cantidad definida de la masa del agua ($M_w$) hasta que alcance su punto de ebullición.
Verter el agua en un recipiente aislante y medir su cantidad (la temperatura agua caliente ($T_i$)).
Pesar una muestra de la masa del cuerpo ($m$) que se encuentra a una temperatura de la temperatura de la muestra ($T_m$).
Introducir la muestra en el recipiente y agitar hasta que alcance la temperatura de la temperatura final ($T_f$).
Calcular el valor de el calor específico de la muestra ($c$).
Diagrama:
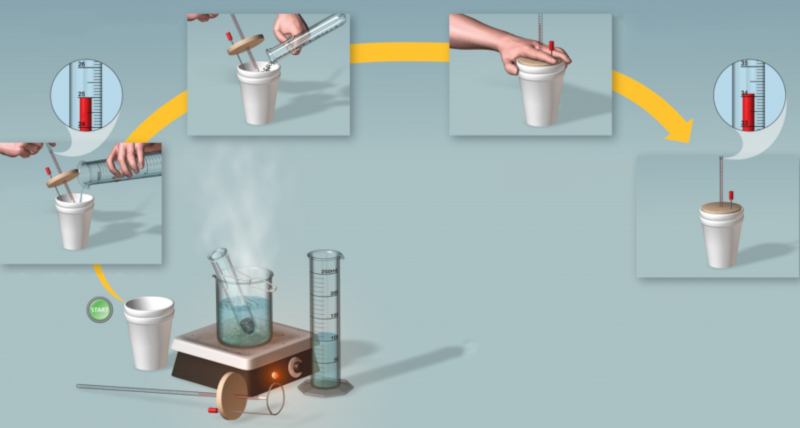
ID:(11119, 0)
Calorimetría en líquidos y sólidos
Descripción 
Para determinar la capacidad calórica o el calor específico de un metal, se sumerge primero el metal en agua hirviendo y luego en agua a temperatura ambiente. A partir de la masa del agua y las variaciones de temperatura observadas, es posible calcular las propiedades térmicas del metal.
Variables
Cálculos
Cálculos
Ecuaciones
(ID 4381)
(ID 4381)
La calor suministrado al liquido o solido ($\Delta Q$) est relacionado con la variación de la temperatura ($\Delta T$) y la capacidad calórica ($C$) de la siguiente manera:
| $ \Delta Q = C \Delta T $ |
Donde la capacidad calórica ($C$) se puede reemplazar por el calor específico ($c$) y la masa ($M$) utilizando la siguiente relaci n:
| $ c =\displaystyle\frac{ C }{ M }$ |
Por lo tanto, se obtiene:
| $ \Delta Q = M c \Delta T$ |
(ID 11112)
La calor suministrado al liquido o solido ($\Delta Q$) est relacionado con la variación de la temperatura ($\Delta T$) y la capacidad calórica ($C$) de la siguiente manera:
| $ \Delta Q = C \Delta T $ |
Donde la capacidad calórica ($C$) se puede reemplazar por el calor específico ($c$) y la masa ($M$) utilizando la siguiente relaci n:
| $ c =\displaystyle\frac{ C }{ M }$ |
Por lo tanto, se obtiene:
| $ \Delta Q = M c \Delta T$ |
(ID 11112)
La relaci n entre la cantidad de calor cedida por el objeto, representada como el diferencia de calor ($\Delta Q$), con una masa de la masa del cuerpo ($m$) y las temperaturas el calor específico de la muestra ($c$), la temperatura final ($T_f$) y la temperatura de la muestra ($T_m$), puede describirse mediante la siguiente ecuaci n:
Esta cantidad de calor es igual a la cantidad de calor absorbida por el agua, que tiene una masa de la masa del agua ($M_w$) y las temperaturas el calor específico del agua ($c_w$), la temperatura agua caliente ($T_i$) y la temperatura final ($T_f$), y se puede expresar con la ecuaci n:
Estas dos cantidades de calor son iguales, por lo que podemos establecer la siguiente igualdad:
$m c (T_f - T_m) = M c_w (T_i - T_f)$
De esta manera, podemos calcular el valor de
| $ c = c_w \displaystyle\frac{ M_w }{ m }\displaystyle\frac{( T_i - T_f )}{( T_f - T_m )}$ |
.
(ID 11117)
(ID 15635)
Ejemplos
La calorimetr a es la pr ctica de medir el calor involucrado en reacciones qu micas, cambios f sicos o capacidad calor fica utilizando un calor metro. En este proceso, se prepara un recipiente bien aislado para minimizar el intercambio de calor con el entorno, y se coloca dentro la sustancia o reacci n de inter s. Una vez que comienza la reacci n o proceso, el calor metro se sella para asegurar que no haya influencias externas de calor en la medici n. Los cambios de temperatura se monitorean cuidadosamente con un term metro o sensor de temperatura, y se registran la masa y la capacidad calor fica espec fica de las sustancias involucradas. El calor absorbido o liberado por la sustancia se calcula en funci n de los cambios de temperatura observados.
Existen diferentes tipos de calorimetr a, como la calorimetr a a presi n constante, la calorimetr a de bomba y la calorimetr a diferencial de barrido (DSC), cada una adecuada para tipos espec ficos de reacciones y mediciones. Las aplicaciones de la calorimetr a incluyen la determinaci n de los cambios de entalp a en reacciones qu micas, la medici n de capacidades calor ficas y transiciones de fase, el estudio de las tasas metab licas en sistemas biol gicos y la caracterizaci n de materiales por sus propiedades t rmicas.
En esencia, la calorimetr a implica preparar el montaje experimental, iniciar el proceso, medir los cambios de temperatura con precisi n y calcular la transferencia de calor para analizar las propiedades t rmicas y comportamientos de diversas sustancias y reacciones.
(ID 15248)
Calor metro con carcasa aislante que contiene un term metro y una muestra sumergida en agua. Junto a l, se encuentra un calor metro met lico profesional.

(ID 11120)
Pasos para realizar la medici n:
Calentar una cantidad definida de la masa del agua ($M_w$) hasta que alcance su punto de ebullici n.
Verter el agua en un recipiente aislante y medir su cantidad (la temperatura agua caliente ($T_i$)).
Pesar una muestra de la masa del cuerpo ($m$) que se encuentra a una temperatura de la temperatura de la muestra ($T_m$).
Introducir la muestra en el recipiente y agitar hasta que alcance la temperatura de la temperatura final ($T_f$).
Calcular el valor de el calor específico de la muestra ($c$).
Diagrama:

(ID 11119)
(ID 15307)
En el proceso calorim trico, la enfriamiento de la muestra ($\Delta Q_m$) es igual a la calentamiento del agua ($\Delta Q_w$):
| $ \Delta Q_m = \Delta Q_w $ |
(ID 15635)
La calor suministrado al liquido o solido ($\Delta Q$) se puede calcular con el calor específico ($c$), la masa ($M$) y la variación de la temperatura ($\Delta T$) mediante:
| $ \Delta Q = M c \Delta T$ |
(ID 11112)
La calor suministrado al liquido o solido ($\Delta Q$) se puede calcular con el calor específico ($c$), la masa ($M$) y la variación de la temperatura ($\Delta T$) mediante:
| $ \Delta Q = M c \Delta T$ |
(ID 11112)
Si un sistema est inicialmente a una temperatura en estado inicial ($T_i$) y luego se encuentra a la temperatura en estado final ($T_f$), la variación de la temperatura ($\Delta T$) ser de:
| $ \Delta T = T_f- T_i$ |
La diferencia de temperaturas es independiente de si se expresan en grados Celsius o Kelvin.
(ID 4381)
Si un sistema est inicialmente a una temperatura en estado inicial ($T_i$) y luego se encuentra a la temperatura en estado final ($T_f$), la variación de la temperatura ($\Delta T$) ser de:
| $ \Delta T = T_f- T_i$ |
La diferencia de temperaturas es independiente de si se expresan en grados Celsius o Kelvin.
(ID 4381)
Si se desea determinar el valor de el calor específico de la muestra ($c$), se puede lograr introduciendo un objeto de la masa del cuerpo ($m$) en una masa de la masa del agua ($M_w$) en el punto de ebullici n. Antes de realizar esta acci n, se debe medir la temperatura del objeto, que suele estar a temperatura ambiente, representada como la temperatura de la muestra ($T_m$), y luego la temperatura del objeto sumergido en el agua al final del proceso, que se denota como la temperatura final ($T_f$). Por lo tanto, sabemos que el objeto ha recibido una cantidad de ERROR:9840,0, que podemos calcular utilizando la f rmula:
Donde el calor específico de la muestra ($c$) es el valor que deseamos determinar. El calor que el objeto ha recibido proviene del agua, cuya temperatura ha disminuido desde la temperatura agua caliente ($T_i$) hasta la temperatura final ($T_f$). Esto se puede expresar como:
Donde el calor específico del agua ($c_w$) representa la constante (1 cal/g = 4.186 J/g). Igualando la cantidad de calor, podemos determinar el calor espec fico del objeto utilizando la siguiente ecuaci n:
| $ c = c_w \displaystyle\frac{ M_w }{ m }\displaystyle\frac{( T_i - T_f )}{( T_f - T_m )}$ |
(ID 11117)
ID:(1315, 0)
