Calorimetria prática
Storyboard 
Para medir a capacidade térmica ou o calor específico de um metal, primeiro submerge-se o metal em água fervente e depois em água à temperatura ambiente. Analisando a massa da água e as alterações de temperatura, é possível determinar as propriedades térmicas do metal.
ID:(1315, 0)
Mecanismos
Definição 
A calorimetria é a prática de medir o calor envolvido em reações químicas, mudanças físicas ou capacidade calorífica usando um calorímetro. Nesse processo, um recipiente bem isolado é preparado para minimizar a troca de calor com o ambiente, e a substância ou reação de interesse é colocada dentro dele. Uma vez que a reação ou processo começa, o calorímetro é selado para garantir que não haja influências externas de calor na medição. As mudanças de temperatura são cuidadosamente monitoradas com um termômetro ou sensor de temperatura, e a massa e a capacidade calorífica específica das substâncias envolvidas são registradas. O calor absorvido ou liberado pela substância é então calculado com base nas mudanças de temperatura observadas.
Existem diferentes tipos de calorimetria, como a calorimetria a pressão constante, a calorimetria de bomba e a calorimetria diferencial de varredura (DSC), cada uma adequada para tipos específicos de reações e medições. As aplicações da calorimetria incluem a determinação das mudanças de entalpia em reações químicas, a medição de capacidades caloríficas e transições de fase, o estudo das taxas metabólicas em sistemas biológicos e a caracterização de materiais por suas propriedades térmicas.
Essencialmente, a calorimetria envolve a preparação do aparato experimental, a iniciação do processo, a medição precisa das mudanças de temperatura e o cálculo da transferência de calor para analisar as propriedades térmicas e os comportamentos de várias substâncias e reações.
ID:(15248, 0)
Experimento: contêiner e diagrama de amostra
Imagem 
Calorímetro isolado com um termômetro e uma amostra dentro da água. Ao lado, um calorímetro metálico profissional.
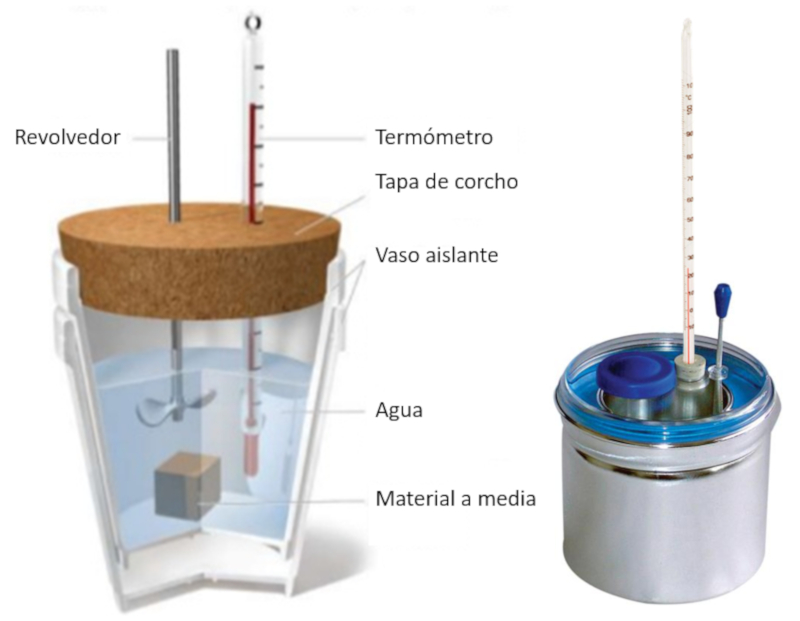
ID:(11120, 0)
Experimento: procedimento de calorimetria
Nota 
Passos para realizar a medição:
Aqueça uma quantidade definida de ERROR:8084 até atingir o ponto de ebulição.
Despeje a água em um recipiente isolante e meça a quantidade (la temperatura da água quente ($T_i$)).
Pese uma amostra de la massa corporal ($m$) que esteja a uma temperatura de la temperatura da amostra ($T_m$).
Coloque a amostra no recipiente e agite até atingir a temperatura de ERROR:8054.
Calcule o valor de o calor específico da amostra ($c$).
Diagrama:
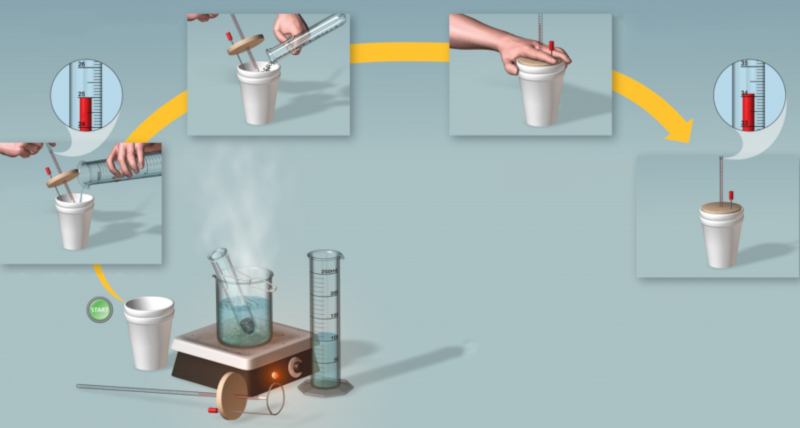
ID:(11119, 0)
Calorimetria em líquidos e sólidos
Descrição 
Para medir a capacidade térmica ou o calor específico de um metal, primeiro submerge-se o metal em água fervente e depois em água à temperatura ambiente. Analisando a massa da água e as alterações de temperatura, é possível determinar as propriedades térmicas do metal.
Variáveis
Cálculos
Cálculos
Equações
(ID 4381)
(ID 4381)
La calor fornecido ao líquido ou sólido ($\Delta Q$) est relacionado com la variação de temperatura ($\Delta T$) e la capacidade calórica ($C$) da seguinte forma:
| $ \Delta Q = C \Delta T $ |
Onde la capacidade calórica ($C$) pode ser substitu do por o calor específico ($c$) e la massa ($M$) usando a seguinte rela o:
| $ c =\displaystyle\frac{ C }{ M }$ |
Portanto, obtemos:
| $ \Delta Q = M c \Delta T$ |
(ID 11112)
La calor fornecido ao líquido ou sólido ($\Delta Q$) est relacionado com la variação de temperatura ($\Delta T$) e la capacidade calórica ($C$) da seguinte forma:
| $ \Delta Q = C \Delta T $ |
Onde la capacidade calórica ($C$) pode ser substitu do por o calor específico ($c$) e la massa ($M$) usando a seguinte rela o:
| $ c =\displaystyle\frac{ C }{ M }$ |
Portanto, obtemos:
| $ \Delta Q = M c \Delta T$ |
(ID 11112)
A rela o entre a quantidade de calor liberada pelo objeto, representada como o diferença de calor ($\Delta Q$), com uma massa de la massa corporal ($m$), e as temperaturas o calor específico da amostra ($c$), ERROR:8054 e la temperatura da amostra ($T_m$), pode ser descrita pela seguinte equa o:
Essa quantidade de calor igual quantidade de calor absorvida pela gua, que tem uma massa de ERROR:8084 e temperaturas o calor específico da água ($c_w$), la temperatura da água quente ($T_i$) e ERROR:8054, e pode ser expressa pela equa o:
Essas duas quantidades de calor s o iguais, ent o podemos estabelecer a seguinte igualdade:
$m c (T_f - T_m) = M c_w (T_i - T_f)$
Dessa forma, podemos calcular o valor de
| $ c = c_w \displaystyle\frac{ M_w }{ m }\displaystyle\frac{( T_i - T_f )}{( T_f - T_m )}$ |
.
(ID 11117)
(ID 15635)
Exemplos
A calorimetria a pr tica de medir o calor envolvido em rea es qu micas, mudan as f sicas ou capacidade calor fica usando um calor metro. Nesse processo, um recipiente bem isolado preparado para minimizar a troca de calor com o ambiente, e a subst ncia ou rea o de interesse colocada dentro dele. Uma vez que a rea o ou processo come a, o calor metro selado para garantir que n o haja influ ncias externas de calor na medi o. As mudan as de temperatura s o cuidadosamente monitoradas com um term metro ou sensor de temperatura, e a massa e a capacidade calor fica espec fica das subst ncias envolvidas s o registradas. O calor absorvido ou liberado pela subst ncia ent o calculado com base nas mudan as de temperatura observadas.
Existem diferentes tipos de calorimetria, como a calorimetria a press o constante, a calorimetria de bomba e a calorimetria diferencial de varredura (DSC), cada uma adequada para tipos espec ficos de rea es e medi es. As aplica es da calorimetria incluem a determina o das mudan as de entalpia em rea es qu micas, a medi o de capacidades calor ficas e transi es de fase, o estudo das taxas metab licas em sistemas biol gicos e a caracteriza o de materiais por suas propriedades t rmicas.
Essencialmente, a calorimetria envolve a prepara o do aparato experimental, a inicia o do processo, a medi o precisa das mudan as de temperatura e o c lculo da transfer ncia de calor para analisar as propriedades t rmicas e os comportamentos de v rias subst ncias e rea es.
(ID 15248)
Calor metro isolado com um term metro e uma amostra dentro da gua. Ao lado, um calor metro met lico profissional.

(ID 11120)
Passos para realizar a medi o:
Aque a uma quantidade definida de ERROR:8084 at atingir o ponto de ebuli o.
Despeje a gua em um recipiente isolante e me a a quantidade (la temperatura da água quente ($T_i$)).
Pese uma amostra de la massa corporal ($m$) que esteja a uma temperatura de la temperatura da amostra ($T_m$).
Coloque a amostra no recipiente e agite at atingir a temperatura de ERROR:8054.
Calcule o valor de o calor específico da amostra ($c$).
Diagrama:

(ID 11119)
(ID 15307)
No processo calorim trico, la resfriamento de amostra ($\Delta Q_m$) igual a la aquecimento de água ($\Delta Q_w$):
| $ \Delta Q_m = \Delta Q_w $ |
(ID 15635)
La calor fornecido ao líquido ou sólido ($\Delta Q$) pode ser calculado com o calor específico ($c$), la massa ($M$) e la variação de temperatura ($\Delta T$) usando:
| $ \Delta Q = M c \Delta T$ |
(ID 11112)
La calor fornecido ao líquido ou sólido ($\Delta Q$) pode ser calculado com o calor específico ($c$), la massa ($M$) e la variação de temperatura ($\Delta T$) usando:
| $ \Delta Q = M c \Delta T$ |
(ID 11112)
Se um sistema est inicialmente a uma temperatura no estado inicial ($T_i$) e depois est a la temperatura no estado final ($T_f$), a diferen a ser de:
| $ \Delta T = T_f- T_i$ |
A diferen a de temperatura independente de se esses valores est o em graus Celsius ou Kelvin.
(ID 4381)
Se um sistema est inicialmente a uma temperatura no estado inicial ($T_i$) e depois est a la temperatura no estado final ($T_f$), a diferen a ser de:
| $ \Delta T = T_f- T_i$ |
A diferen a de temperatura independente de se esses valores est o em graus Celsius ou Kelvin.
(ID 4381)
Se desejar determinar o valor de o calor específico da amostra ($c$), voc pode fazer isso introduzindo um objeto com uma massa de la massa corporal ($m$) em uma massa de ERROR:8084 no ponto de ebuli o. Antes de realizar essa a o, me a a temperatura do objeto, que geralmente est em temperatura ambiente, representada como la temperatura da amostra ($T_m$), e depois me a a temperatura do objeto submerso na gua no final do processo, representada como ERROR:8054. Portanto, sabemos que o objeto recebeu uma certa quantidade de ERROR:9840,0, que pode ser calculada usando a f rmula:
Onde o calor específico da amostra ($c$) o valor que desejamos determinar. O calor que o objeto recebeu vem da gua, cuja temperatura diminuiu de la temperatura da água quente ($T_i$) para ERROR:8054. Isso pode ser expresso como:
Onde o calor específico da água ($c_w$) representa a constante (1 cal/g = 4,186 J/g). Igualando a quantidade de calor, podemos determinar o calor espec fico do objeto usando a seguinte equa o:
| $ c = c_w \displaystyle\frac{ M_w }{ m }\displaystyle\frac{( T_i - T_f )}{( T_f - T_m )}$ |
(ID 11117)
ID:(1315, 0)
