Lei de Charles
Storyboard 
A lei de Charles estabelece que o quociente entre o volume ($V$) e la temperatura absoluta ($T$) de um gás é constante, desde que a pressão e a quantidade de mols permaneçam inalteradas.
Isso implica que o volume ($V$) varia de forma proporcional a la temperatura absoluta ($T$).
ID:(1473, 0)
Mecanismos
Conceito 
A lei de Charles estabelece que o volume de um gás é diretamente proporcional à sua temperatura quando a pressão é mantida constante. Isso significa que, à medida que a temperatura de um gás aumenta, seu volume também aumenta, desde que a pressão permaneça a mesma. Inversamente, se a temperatura diminui, o volume também diminui. Essa relação é fundamental para entender o comportamento dos gases e é frequentemente observada ao aquecer ou resfriar um gás em um recipiente flexível, como um balão, onde a mudança de temperatura resulta em uma mudança notável de volume.
ID:(15255, 0)
Variação de volume e temperatura
Conceito 
A geração de la pressão ($p$) ocorre quando as partículas de gás colidem com a superfície do recipiente de gás. Cada colisão transmite um momento igual ao dobro de la massa molar ($m$) vezes la velocidade média de uma partícula ($\bar{v}$). Além disso, é importante considerar o fluxo de partículas em direção à superfície, que depende de la concentração de partículas ($c_n$), mas também de la velocidade média de uma partícula ($\bar{v}$), com o qual se deslocam. Portanto,
$p \propto c_n v \cdot m v = c_n m v^2$
O fluxo de partículas e a transmissão do momento são representados no seguinte gráfico:
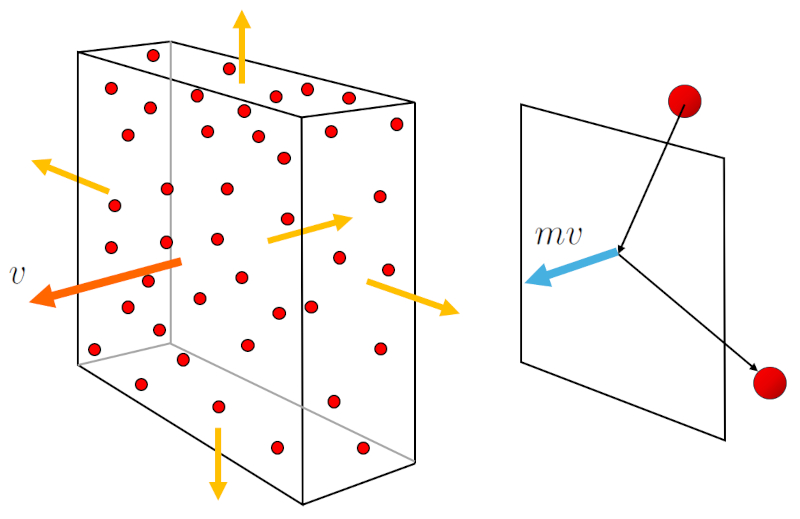
Dado que la massa molar ($m$) vezes la velocidade média de uma partícula ($\bar{v}$) ao quadrado é proporcional à energia, e esta à La temperatura absoluta ($T$),
$mv^2 \propto E \propto T$
e, dado que o número de partículas ($N$) é constante, la concentração de partículas ($c_n$) é inversamente proporcional a o volume ($V$):
$c_n \propto \displaystyle\frac{1}{V}$
Como la pressão ($p$) é constante, temos:
$p \propto \displaystyle\frac{T}{V}$
o que implica:
$V \propto T$
ID:(15689, 0)
Significado de temperatura absoluta
Descrição 
A temperatura corresponde à energia térmica (movimento) contida em um objeto.
Uma vez que a energia é sempre positiva, escalas de temperatura como Celsius e Fahrenheit, que podem assumir valores negativos, podem parecer não intuitivas. No entanto, a relação entre energia e temperatura leva à conclusão de que deve existir uma temperatura mínima, conhecida como temperatura zero absoluto, na qual a energia de um sistema de partículas é nula.
Além disso, em 1802, Gay-Lussac observou que nos gases existe uma relação proporcional entre o volume e a temperatura. Essa proporção implica que um gás atingiria um volume de zero a uma temperatura de -273,15 graus Celsius (de acordo com medições modernas), o que é conhecido como temperatura absoluta zero:
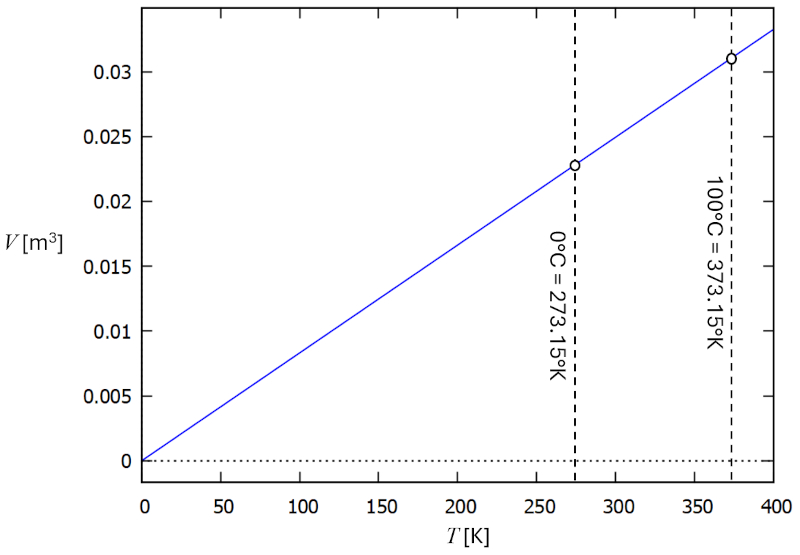
Isso implica na existência de tal escala, que foi denominada a escala de temperatura absoluta medida em graus Kelvin. Outras escalas, como as temperaturas $t$ em graus Celsius ou Fahrenheit, podem ser convertidas para
Celsius:
$T = 273.15 + t$
Fahrenheit:
$T = 255.37 + \displaystyle\frac{5}{9} t$
ID:(111, 0)
Igualdade das diferenças de temperatura Celsius e Kelvin
Conceito 
La diferença de temperatura em graus Celsius ($\Delta t$), combinado com la temperatura em graus Celsius no estado 1 ($t_1$) e la temperatura em graus Celsius no estado 2 ($t_2$), resulta em:
$\Delta t = t_2 - t_1$
Se expressarmos ambas as temperaturas em graus Kelvin, temos que la temperatura no estado 1 ($T_1$) é igual a:
$T_1 = t_1 + 273.15 , \text{K}$
e la temperatura no estado 2 ($T_2$) é igual a:
$T_2 = t_2 + 273.15 , \text{K}$
Portanto, a diferença de temperaturas em Kelvin, denominada la diferença de temperatura ($\Delta T$), é calculada como:
$\Delta T=T_2-T_1=t_2-t_1=\Delta t$
Isso implica:
| $ \Delta T = \Delta t $ |
O que significa que a diferença entre as temperaturas em graus Celsius e Kelvin permanece a mesma.
ID:(15694, 0)
Relação temperatura x volume
Descrição 
Em um gás, quando la pressão ($p$) e o número de partículas ($N$) são mantidos constantes, observa-se que o volume ($V$) e la temperatura absoluta ($T$) variam de forma proporcional. Quando o volume ($V$) diminui, la temperatura absoluta ($T$) também diminui, e vice-versa,
$V \propto T$
como mostrado no seguinte gráfico:
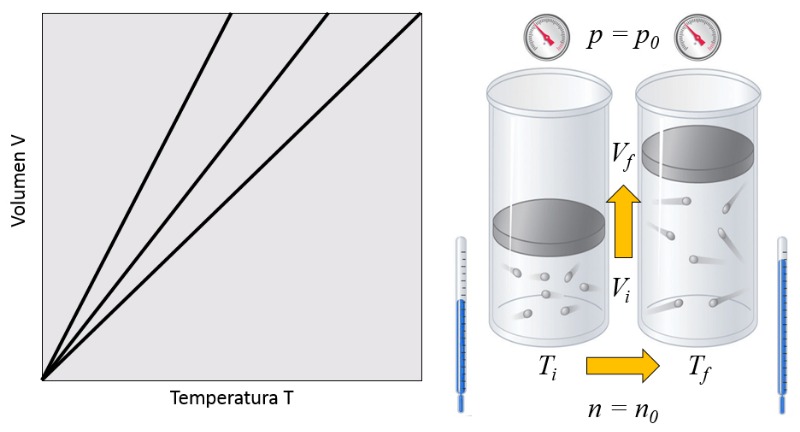
A lei de Charles [1] afirma que, com la pressão ($p$) e o número de partículas ($N$) constantes, o volume ($V$) e la temperatura absoluta ($T$) são diretamente proporcionais.
Isso pode ser expresso com la constante da lei de Charles ($C_c$) da seguinte forma:
| $\displaystyle\frac{ V }{ T } = C_c$ |
![]() [1] "Sur la dilatação dos gases e vapores" (Sobre a expansão dos gases e vapores), Jacques Charles, Academia Francesa de Ciências (1787)
[1] "Sur la dilatação dos gases e vapores" (Sobre a expansão dos gases e vapores), Jacques Charles, Academia Francesa de Ciências (1787)
ID:(9529, 0)
Jacques Charles
Descrição 
Jacques Charles, nascido em 12 de novembro de 1746 e falecido em 7 de abril de 1823, foi um físico, inventor e aeronauta francês. Ele é conhecido principalmente por seu trabalho pioneiro no campo da aeronáutica e por suas descobertas relacionadas ao comportamento dos gases. Em 1783, realizou o primeiro voo tripulado em um balão cheio de hidrogênio, em parceria com o químico Nicolas-Louis Robert. Esse voo bem-sucedido marcou um marco importante na história da aviação. Charles também fez contribuições importantes para a compreensão das leis dos gases, incluindo a Lei de Charles, que descreve a relação entre o volume e a temperatura de um gás a pressão constante.
Nota: A Lei de Charles foi tornada pública por Joseph Louis Gay-Lussac, que a atribuiu a Jacques Charles, citando um artigo não publicado.

ID:(1656, 0)
Mudança de estado de um gás ideal de acordo com a lei de Charles
Conceito 
A lei de Charles estabelece que, com la pressão ($p$) constante, a proporção de o volume ($V$) com la temperatura absoluta ($T$) é igual a la constante da lei de Charles ($C_c$):
| $\displaystyle\frac{ V }{ T } = C_c$ |
Isso significa que se um gás passa de um estado inicial (o volume no estado i ($V_i$) e la temperatura no estado inicial ($T_i$)) para um estado final (o volume no estado f ($V_f$) e la temperatura no estado final ($T_f$)), mantendo la pressão ($p$) constante, ele deve sempre obedecer à lei de Charles:
$\displaystyle\frac{V_i}{T_i} = C_c = \displaystyle\frac{V_f}{T_f}$
Portanto, temos:
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
ID:(15692, 0)
Equivalente à lei de Charles para densidades
Conceito 
Se em um processo isotérmico, no qual o conteúdo permanece constante, tivermos que la temperatura no estado inicial ($T_i$), la temperatura no estado final ($T_f$), o volume no estado i ($V_i$) e o volume no estado f ($V_f$) estão relacionados pela seguinte equação:
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
Então, podemos introduzir la densidade ($\rho$), que, juntamente com la massa ($M$) e o volume ($V$), satisfaz:
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
Isso nos leva a la densidade no estado i ($\rho_i$) e la densidade no estado f ($\rho_f$) como:
| $ \rho_i T_i = \rho_f T_f $ |
ID:(15693, 0)
Lei de Charles
Modelo 
A lei de Charles estabelece que o quociente entre 5226 e 5177 de um gás é constante, desde que a pressão e a quantidade de mols permaneçam inalteradas. Isso implica que 5226 varia de forma proporcional a 5177.
Variáveis
Cálculos
Cálculos
Equações
A lei de Charles estabelece que, com la pressão ($p$) constante, a propor o de o volume ($V$) com la temperatura absoluta ($T$) igual a la constante da lei de Charles ($C_c$):
| $\displaystyle\frac{ V }{ T } = C_c$ |
Isso significa que se um g s passa de um estado inicial (o volume no estado i ($V_i$) e la temperatura no estado inicial ($T_i$)) para um estado final (o volume no estado f ($V_f$) e la temperatura no estado final ($T_f$)), mantendo la pressão ($p$) constante, ele deve sempre obedecer lei de Charles:
$\displaystyle\frac{V_i}{T_i} = C_c = \displaystyle\frac{V_f}{T_f}$
Portanto, temos:
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
(ID 3492)
Se em um processo isot rmico, no qual o conte do permanece constante, tivermos que la temperatura no estado inicial ($T_i$), la temperatura no estado final ($T_f$), o volume no estado i ($V_i$) e o volume no estado f ($V_f$) est o relacionados pela seguinte equa o:
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
Ent o, podemos introduzir la densidade ($\rho$), que, juntamente com la massa ($M$) e o volume ($V$), satisfaz:
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
Isso nos leva a la densidade no estado i ($\rho_i$) e la densidade no estado f ($\rho_f$) como:
| $ \rho_i T_i = \rho_f T_f $ |
(ID 8835)
Exemplos
A lei de Charles estabelece que o volume de um g s diretamente proporcional sua temperatura quando a press o mantida constante. Isso significa que, medida que a temperatura de um g s aumenta, seu volume tamb m aumenta, desde que a press o permane a a mesma. Inversamente, se a temperatura diminui, o volume tamb m diminui. Essa rela o fundamental para entender o comportamento dos gases e frequentemente observada ao aquecer ou resfriar um g s em um recipiente flex vel, como um bal o, onde a mudan a de temperatura resulta em uma mudan a not vel de volume.
(ID 15255)
A gera o de la pressão ($p$) ocorre quando as part culas de g s colidem com a superf cie do recipiente de g s. Cada colis o transmite um momento igual ao dobro de la massa molar ($m$) vezes la velocidade média de uma partícula ($\bar{v}$). Al m disso, importante considerar o fluxo de part culas em dire o superf cie, que depende de la concentração de partículas ($c_n$), mas tamb m de la velocidade média de uma partícula ($\bar{v}$), com o qual se deslocam. Portanto,
$p \propto c_n v \cdot m v = c_n m v^2$
O fluxo de part culas e a transmiss o do momento s o representados no seguinte gr fico:

Dado que la massa molar ($m$) vezes la velocidade média de uma partícula ($\bar{v}$) ao quadrado proporcional energia, e esta la temperatura absoluta ($T$),
$mv^2 \propto E \propto T$
e, dado que o número de partículas ($N$) constante, la concentração de partículas ($c_n$) inversamente proporcional a o volume ($V$):
$c_n \propto \displaystyle\frac{1}{V}$
Como la pressão ($p$) constante, temos:
$p \propto \displaystyle\frac{T}{V}$
o que implica:
$V \propto T$
(ID 15689)
A temperatura corresponde energia t rmica (movimento) contida em um objeto.
Uma vez que a energia sempre positiva, escalas de temperatura como Celsius e Fahrenheit, que podem assumir valores negativos, podem parecer n o intuitivas. No entanto, a rela o entre energia e temperatura leva conclus o de que deve existir uma temperatura m nima, conhecida como temperatura zero absoluto, na qual a energia de um sistema de part culas nula.
Al m disso, em 1802, Gay-Lussac observou que nos gases existe uma rela o proporcional entre o volume e a temperatura. Essa propor o implica que um g s atingiria um volume de zero a uma temperatura de -273,15 graus Celsius (de acordo com medi es modernas), o que conhecido como temperatura absoluta zero:

Isso implica na exist ncia de tal escala, que foi denominada a escala de temperatura absoluta medida em graus Kelvin. Outras escalas, como as temperaturas $t$ em graus Celsius ou Fahrenheit, podem ser convertidas para
Celsius:
$T = 273.15 + t$
Fahrenheit:
$T = 255.37 + \displaystyle\frac{5}{9} t$
(ID 111)
La diferença de temperatura em graus Celsius ($\Delta t$), combinado com la temperatura em graus Celsius no estado 1 ($t_1$) e la temperatura em graus Celsius no estado 2 ($t_2$), resulta em:
$\Delta t = t_2 - t_1$
Se expressarmos ambas as temperaturas em graus Kelvin, temos que la temperatura no estado 1 ($T_1$) igual a:
$T_1 = t_1 + 273.15 , \text{K}$
e la temperatura no estado 2 ($T_2$) igual a:
$T_2 = t_2 + 273.15 , \text{K}$
Portanto, a diferen a de temperaturas em Kelvin, denominada la diferença de temperatura ($\Delta T$), calculada como:
$\Delta T=T_2-T_1=t_2-t_1=\Delta t$
Isso implica:
| $ \Delta T = \Delta t $ |
O que significa que a diferen a entre as temperaturas em graus Celsius e Kelvin permanece a mesma.
(ID 15694)
Em um g s, quando la pressão ($p$) e o número de partículas ($N$) s o mantidos constantes, observa-se que o volume ($V$) e la temperatura absoluta ($T$) variam de forma proporcional. Quando o volume ($V$) diminui, la temperatura absoluta ($T$) tamb m diminui, e vice-versa,
$V \propto T$
como mostrado no seguinte gr fico:

A lei de Charles [1] afirma que, com la pressão ($p$) e o número de partículas ($N$) constantes, o volume ($V$) e la temperatura absoluta ($T$) s o diretamente proporcionais.
Isso pode ser expresso com la constante da lei de Charles ($C_c$) da seguinte forma:
| $\displaystyle\frac{ V }{ T } = C_c$ |
![]() [1] "Sur la dilata o dos gases e vapores" (Sobre a expans o dos gases e vapores), Jacques Charles, Academia Francesa de Ci ncias (1787)
[1] "Sur la dilata o dos gases e vapores" (Sobre a expans o dos gases e vapores), Jacques Charles, Academia Francesa de Ci ncias (1787)
(ID 9529)
Jacques Charles, nascido em 12 de novembro de 1746 e falecido em 7 de abril de 1823, foi um f sico, inventor e aeronauta franc s. Ele conhecido principalmente por seu trabalho pioneiro no campo da aeron utica e por suas descobertas relacionadas ao comportamento dos gases. Em 1783, realizou o primeiro voo tripulado em um bal o cheio de hidrog nio, em parceria com o qu mico Nicolas-Louis Robert. Esse voo bem-sucedido marcou um marco importante na hist ria da avia o. Charles tamb m fez contribui es importantes para a compreens o das leis dos gases, incluindo a Lei de Charles, que descreve a rela o entre o volume e a temperatura de um g s a press o constante.
Nota: A Lei de Charles foi tornada p blica por Joseph Louis Gay-Lussac, que a atribuiu a Jacques Charles, citando um artigo n o publicado.

(ID 1656)
A lei de Charles estabelece que, com la pressão ($p$) constante, a propor o de o volume ($V$) com la temperatura absoluta ($T$) igual a la constante da lei de Charles ($C_c$):
| $\displaystyle\frac{ V }{ T } = C_c$ |
Isso significa que se um g s passa de um estado inicial (o volume no estado i ($V_i$) e la temperatura no estado inicial ($T_i$)) para um estado final (o volume no estado f ($V_f$) e la temperatura no estado final ($T_f$)), mantendo la pressão ($p$) constante, ele deve sempre obedecer lei de Charles:
$\displaystyle\frac{V_i}{T_i} = C_c = \displaystyle\frac{V_f}{T_f}$
Portanto, temos:
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
(ID 15692)
Se em um processo isot rmico, no qual o conte do permanece constante, tivermos que la temperatura no estado inicial ($T_i$), la temperatura no estado final ($T_f$), o volume no estado i ($V_i$) e o volume no estado f ($V_f$) est o relacionados pela seguinte equa o:
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
Ent o, podemos introduzir la densidade ($\rho$), que, juntamente com la massa ($M$) e o volume ($V$), satisfaz:
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
Isso nos leva a la densidade no estado i ($\rho_i$) e la densidade no estado f ($\rho_f$) como:
| $ \rho_i T_i = \rho_f T_f $ |
(ID 15693)
(ID 15314)
ID:(1473, 0)
