Calorimetría
Storyboard
La calorimetría corresponde a la medición del calor que se asocia a un cambio de una variable de estado. Las variables de estado son típicamente la temperatura, la presión y el volumen pudiendo existir otras en función del estado a describir.
En el caso de que se determina la variación de la temperatura en función del calor suministrado o extraído se habla de capacidad calorica. En el caso de un gas la capacidad calórica depende de las restantes variables de estado. Es asi como se define y mide una capacidad calorica a volumen o a presión constante.
ID:(789, 0)
Convertidor de trabajo en calor
Descripción
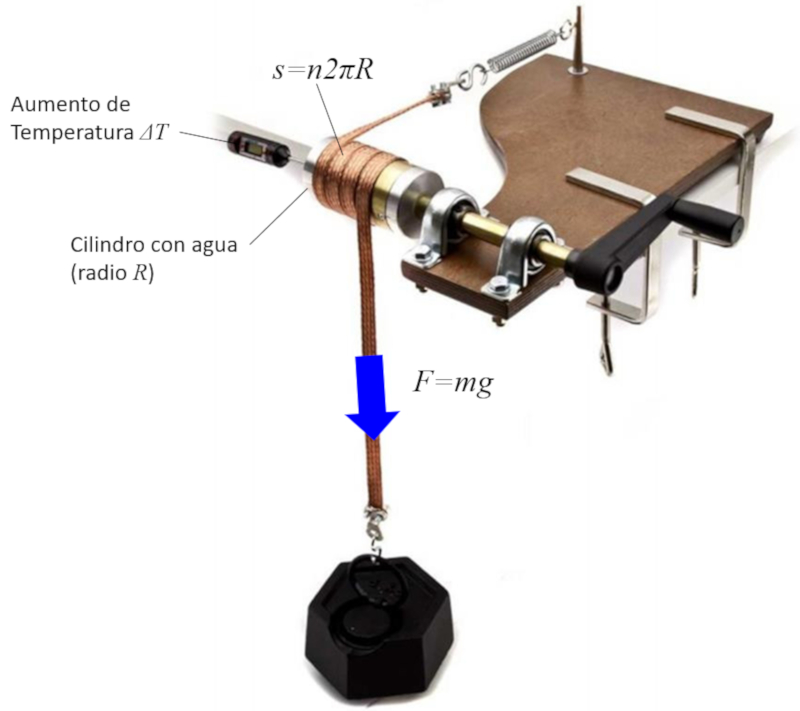
La conversión de trabajo en energía se estudia mediante la generación de calor a través del rozamiento. Para este fin, se coloca una banda metálica alrededor de un cilindro que contiene agua y un termómetro. Al girar la manivela, el rozamiento genera calor, lo que resulta en el calentamiento del agua. Si se mide la fuerza aplicada, el número de vueltas realizadas y el radio del cilindro, es posible estimar la distancia recorrida, lo que permite estimar la energía como el producto de la fuerza por la distancia.
ID:(1884, 0)
Calentamiento bajo presión volumen
Descripción
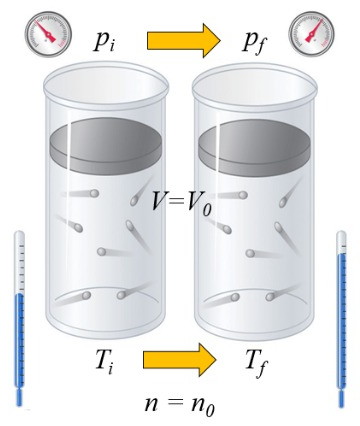
Si se calienta un gas, la capacidad calorífica depende de la forma en que esto ocurre. Una forma es a volumen constante, es decir, se mantiene el volumen fijo y se permite que el sistema sea expuesto a una presión mayor o menor:
ID:(11190, 0)
Calentamiento bajo presión constante
Descripción
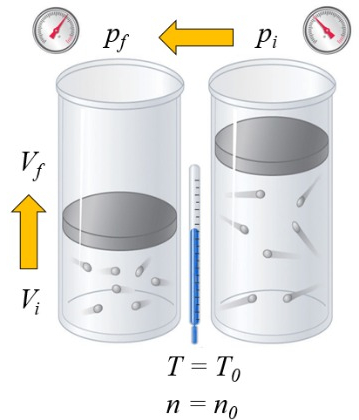
Si se calienta un gas, la capacidad calorífica depende de la forma en que esto ocurre. Una forma es a presión constante, es decir, se permite que el volumen se expanda o contraiga de modo que la presión se mantenga constante:
ID:(11189, 0)
Contenido calórico
Ecuación
Cuando se añaden la variación de calor ($\Delta Q$) a un cuerpo, se observa un aumento de la variación de temperatura ($\Delta T$) de manera proporcional. Por lo tanto, podemos introducir una constante de proporcionalidad la capacidad calórica ($C$), llamada capacidad térmica, que establece la siguiente relación:
ID:(3197, 0)
Contenido calórico de un gas a volumen constante
Ecuación
La capacidad calórica ($C$) en sólidos y líquidos puede considerarse como una constante $C$ que relaciona la variación de la variación del calor ($\Delta Q$) y la variación de Temperature ($\Delta T$) mediante la ecuación:
| $ \Delta Q = C \Delta T $ |
En el caso de un gas, el estado depende de la temperatura absoluta ($T$), la presión ($p$) y el volumen ($V$). Por lo tanto, si se agrega calor, el aumento de temperatura dependerá de si se mantiene constante el volumen o la presión. En el primer caso, se habla de la capacidad calórica a volumen constante ($C_V$) y se denota como $C_V$, y la relación es la siguiente:
ID:(4862, 0)
Contenido calórico de un gas a presión constante
Ecuación
La capacidad calórica ($C$) en sólidos y líquidos puede considerarse como una constante $C$ que relaciona la variación de la variación del calor ($\Delta Q$) y la variación de Temperature ($\Delta T$) mediante la ecuación:
| $ \Delta Q = C \Delta T $ |
En el caso de un gas, el estado depende de la temperatura absoluta ($T$), la presión ($p$) y el volumen ($V$). Por lo tanto, si se agrega calor, el aumento de temperatura dependerá de si se mantiene constante el volumen o la presión. En el primer caso, se habla de la capacidad calórica a presión constante ($C_p$) y se denota como $C_p$, y la relación es la siguiente:
ID:(4863, 0)
Calor específico
Ecuación
La capacidad calórica está relacionada con las oscilaciones a nivel microscópico, por lo que depende menos de la masa y más del número de átomos. Por esta razón, tiene sentido introducir el concepto de el calor específico ($c$), que se calcula como la capacidad calórica ($C$) por unidad de la masa ($M$), de la siguiente manera:
ID:(3483, 0)
Contenido calórico en función del calor especifico
Ecuación
La relación entre la variación de calor ($\Delta Q$) y la variación de la variación de temperatura ($\Delta T$) en un sólido o líquido se establece mediante la capacidad calórica ($C$), de acuerdo con la siguiente ecuación:
| $ \Delta Q = C \Delta T $ |
Al introducir el calor específico ($c$) y la masa ($M$), la ecuación se puede expresar de la siguiente manera:
La variación de calor ($\Delta Q$) está relacionado con la variación de temperatura ($\Delta T$) y la capacidad calórica ($C$) de la siguiente manera:
| $ \Delta Q = C \Delta T $ |
Donde la capacidad calórica ($C$) se puede reemplazar por el calor específico ($c$) y la masa ($M$) utilizando la siguiente relación:
| $ c =\displaystyle\frac{ C }{ M }$ |
Por lo tanto, se obtiene:
| $ \Delta Q = M c \Delta T$ |
Dado que el calor específico no depende de la cantidad de masa, su valor solamente se relaciona con el tipo de material. Esto facilita su medición, tabulación y consulta posterior para su uso.
ID:(11112, 0)
Calor específico de gases a volumen constante
Ecuación
Siguiendo una analogía al calor específico ($c$) de líquidos y sólidos con la capacidad calórica ($C$) y la masa ($M$):
| $ c =\displaystyle\frac{ C }{ M }$ |
existe también un calor específico de gases a volumen constante ($c_V$) para calentamiento bajo volumen constante con la capacidad calórica a volumen constante ($C_V$):
ID:(11113, 0)
Contenido calórico de un gas a volumen constante en función de calor especifico
Ecuación
La relación entre la variación de la variación de calor ($\Delta Q$) y la variación de temperatura ($\Delta T$) en un gas a volumen constante se establece mediante la capacidad calórica a volumen constante ($C_V$), de acuerdo con la siguiente ecuación:
| $ \Delta Q = C_V \Delta T $ |
Introduciendo el calor específico de gases a volumen constante ($c_V$) y la masa ($M$), la ecuación se puede escribir de la siguiente manera:
La variación de calor ($\Delta Q$) en relación con la variación de temperatura ($\Delta T$) y la capacidad calórica a volumen constante ($C_V$) se expresa como:
| $ \Delta Q = C_V \Delta T $ |
Donde la capacidad calórica a volumen constante ($C_V$) puede ser reemplazado por el calor específico de gases a volumen constante ($c_V$) y la masa ($M$) utilizando la siguiente relación:
| $ c_V =\displaystyle\frac{ C_V }{ M }$ |
Por lo tanto, obtenemos:
| $ \Delta Q = c_V M \Delta T $ |
Dado que el calor específico a volumen constante no depende de la cantidad de masa, su valor solo depende del tipo de gas. Esto permite su medición y tabulación para su posterior consulta y uso.
ID:(11115, 0)
Calor específico de gases a presión constante
Ecuación
Siguiendo una analogía al calor específico ($c$) de líquidos y sólidos con la capacidad calórica ($C$) y la masa ($M$):
| $ c =\displaystyle\frac{ C }{ M }$ |
existe también un calor especifico a presión constante ($c_p$) para calentamiento bajo presión constante con la capacidad calórica a presión constante ($C_p$):
ID:(11114, 0)
Contenido calórico de un gas a presión constante en función de calor especifico
Ecuación
La relación entre la variación de la variación de calor ($\Delta Q$) y la variación de temperatura ($\Delta T$) en un gas a presión constante se establece mediante la capacidad calórica a presión constante ($C_p$), de acuerdo con la siguiente ecuación:
| $ \Delta Q = C_V \Delta T $ |
Introduciendo el calor especifico a presión constante ($c_p$) y la masa ($M$), la ecuación se puede expresar de la siguiente manera:
La variación de calor ($\Delta Q$) en relación con la variación de temperatura ($\Delta T$) y la capacidad calórica a presión constante ($C_p$) se expresa de la siguiente manera:
| $ \Delta Q = C_p \Delta T $ |
Donde la capacidad calórica a presión constante ($C_p$) puede ser reemplazado por el calor especifico a presión constante ($c_p$) y la masa ($M$) utilizando la siguiente relación:
| $ c_p =\displaystyle\frac{ C_p }{ M }$ |
Por lo tanto, obtenemos:
| $ \Delta Q = c_p M \Delta T $ |
Dado que el calor específico a presión constante no depende de la cantidad de masa, su valor solo depende del tipo de gas. Esto permite su medición y tabulación para su posterior consulta y uso.
ID:(11116, 0)
Experimento: Calorimetría
Ecuación
Si se desea determinar el valor de el calor específico de la muestra ($c$), se puede lograr introduciendo un objeto de la masa del objeto ($m$) en una masa de la masa del agua ($M_w$) en el punto de ebullición. Antes de realizar esta acción, se debe medir la temperatura del objeto, que suele estar a temperatura ambiente, representada como la temperatura de la muestra ($T_m$), y luego la temperatura del objeto sumergido en el agua al final del proceso, que se denota como la temperatura final ($T_f$). Por lo tanto, sabemos que el objeto ha recibido una cantidad de diferencia de calor ($\Delta Q$), que podemos calcular utilizando la fórmula:
$\Delta Q = m c (T_f - T_m)$
Donde el calor específico de la muestra ($c$) es el valor que deseamos determinar. El calor que el objeto ha recibido proviene del agua, cuya temperatura ha disminuido desde la temperatura agua caliente ($T_i$) hasta la temperatura final ($T_f$). Esto se puede expresar como:
$\Delta Q = M c_w (T_i - T_f)$
Donde el calor específico del agua ($c_w$) representa la constante (1 cal/g = 4.186 J/g). Igualando la cantidad de calor, podemos determinar el calor específico del objeto utilizando la siguiente ecuación:
La relación entre la cantidad de calor cedida por el objeto, representada como el diferencia de calor ($\Delta Q$), con una masa de la masa del objeto ($m$) y las temperaturas el calor específico de la muestra ($c$), la temperatura final ($T_f$) y la temperatura de la muestra ($T_m$), puede describirse mediante la siguiente ecuación:
$\Delta Q = M c (T_f - T_m)$
Esta cantidad de calor es igual a la cantidad de calor absorbida por el agua, que tiene una masa de la masa del agua ($M_w$) y las temperaturas el calor específico del agua ($c_w$), la temperatura agua caliente ($T_i$) y la temperatura final ($T_f$), y se puede expresar con la ecuación:
$\Delta Q = M c_w (T_i - T_f)$
Estas dos cantidades de calor son iguales, por lo que podemos establecer la siguiente igualdad:
$m c (T_f - T_m) = M c_w (T_i - T_f)$
De esta manera, podemos calcular el valor de
| $ c = c_w \displaystyle\frac{ M_w }{ m }\displaystyle\frac{( T_i - T_f )}{( T_f - T_m )}$ |
.
ID:(11117, 0)
Video: Calorimetría
Descripción
Mini clase que explica los conceptos y el desarrollo de las ecuaciones claves del tema.
ID:(11198, 0)
0
Video
Video: Calorimetría
