Dritter Hauptsatz der Thermodynamik
Storyboard 
Das dritte Gesetz der Thermodynamik besagt, dass sich die Entropie eines Systems einem konstanten Wert nähert, wenn die Temperatur sich dem absoluten Nullpunkt annähert. In der Regel ist dieser konstante Wert null, was bedeutet, dass nur ein einziger mikroskopischer Zustand für das System möglich ist.
ID:(1468, 0)
Dritter Hauptsatz der Thermodynamik
Storyboard 
Das dritte Gesetz der Thermodynamik besagt, dass sich die Entropie eines Systems einem konstanten Wert nähert, wenn die Temperatur sich dem absoluten Nullpunkt annähert. In der Regel ist dieser konstante Wert null, was bedeutet, dass nur ein einziger mikroskopischer Zustand für das System möglich ist.
Variablen
Berechnungen
Berechnungen
Gleichungen
Die Beziehung von die Variation des Wärme ($\delta Q$) zu die Absolute Temperatur ($T$) und die Entropievariation ($dS$) kann wie folgt ausgedr ckt werden:
Wenn dies in Verbindung mit der Beziehung zwischen die Der Flüssigkeit oder dem Feststoff zugeführte Wärme ($\Delta Q$), die Kalorische Kapazität ($C$) und die Temperaturschwankungen ($\Delta T$) gebracht wird:
erhalten wir diese Beziehung im infinitesimalen Grenzwert, wobei gilt:
$\delta Q = C dT = T dS$
Nach der Integration gelangen wir zu folgender Gleichung:
mit der Bedingung, dass die Basisentropie ($S_0$) kleiner ist als die Basistemperatur ($T_0$).
Beispiele
Das dritte Gesetz der Thermodynamik besagt, dass die Entropie eines Systems beim Ann hern an den absoluten Nullpunkt ein Minimum erreicht. Am absoluten Nullpunkt wird die Entropie einer perfekt kristallinen Substanz null. Dieses Gesetz impliziert, dass es unm glich ist, den absoluten Nullpunkt durch eine endliche Anzahl von Prozessen zu erreichen. Das dritte Gesetz bietet auch einen Referenzpunkt f r die Bestimmung der Entropie, was sicherstellt, dass die Entropiewerte absolut und nicht relativ sind. Es hat bedeutende Auswirkungen auf das Verhalten von Materialien bei sehr niedrigen Temperaturen und beeinflusst Ph nomene wie Supraleitung und die spezifische W rme von Substanzen. Im Wesentlichen etabliert das dritte Gesetz eine Basislinie f r die Entropie und unterstreicht die Unm glichkeit, den absoluten Nullpunkt zu erreichen, und betont die inh renten Beschr nkungen in K hlprozessen.
Das dritte Gesetz der Thermodynamik [1] besagt, dass, wenn die die Absolute Temperatur ($T$) eines Systems dem absoluten Nullpunkt n herkommt, die die Entropie in der Nulltemperaturgrenze ($S$) einer perfekten kristallinen Substanz einen Minimalwert erreicht, typischerweise null. Dies impliziert, dass es unm glich ist, den absoluten Nullpunkt durch eine endliche Anzahl von Prozessen zu erreichen, da die Entropie konstant werden w rde. Im Wesentlichen stellt das dritte Gesetz fest, dass die Entropie eines perfekten Kristalls bei absolutem Nullpunkt null ist und hebt die Unm glichkeit hervor, den absoluten Nullpunkt zu erreichen, aufgrund der unendlichen Energiemenge, die zur Entfernung erforderlich w re.
Dieses Gesetz hat bedeutende Auswirkungen auf das Verst ndnis des Verhaltens von Materialien bei sehr niedrigen Temperaturen und bietet einen grundlegenden Bezugspunkt zur Berechnung von Entropiewerten.
![]() [1] " ber die Berechnung chemischer Gleichgewichte aus thermischen Messungen", Walther Nernst, Nachrichten von der Gesellschaft der Wissenschaften zu G ttingen, Mathematisch-Physikalische Klasse, 1906
[1] " ber die Berechnung chemischer Gleichgewichte aus thermischen Messungen", Walther Nernst, Nachrichten von der Gesellschaft der Wissenschaften zu G ttingen, Mathematisch-Physikalische Klasse, 1906
Die Beziehung von die Variation des Wärme ($\delta Q$) zu die Absolute Temperatur ($T$) und die Entropievariation ($dS$) kann wie folgt ausgedr ckt werden:
Wenn dies in Verbindung mit der Beziehung zwischen die Der Flüssigkeit oder dem Feststoff zugeführte Wärme ($\Delta Q$), die Kalorische Kapazität ($C$) und die Temperaturschwankungen ($\Delta T$) gebracht wird:
erhalten wir diese Beziehung im infinitesimalen Grenzwert, wobei gilt:
$\delta Q = C dT = T dS$
Nach der Integration gelangen wir zu folgender Gleichung:
mit der Bedingung, dass die Basisentropie ($S_0$) kleiner ist als die Basistemperatur ($T_0$).
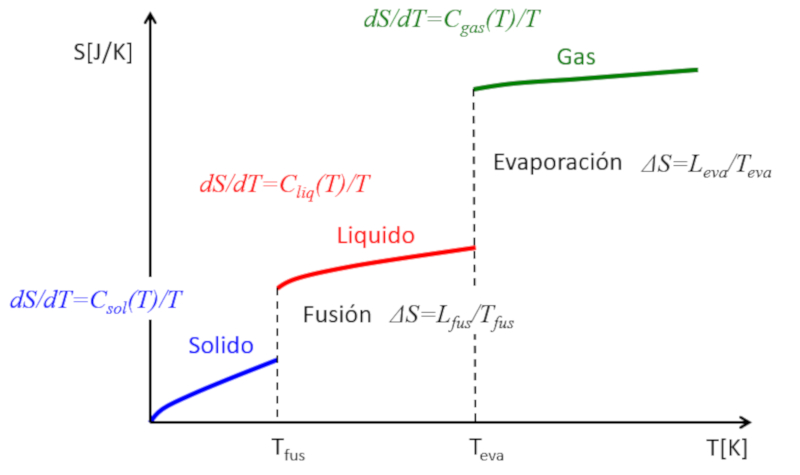
Wenn die Entropie in Abh ngigkeit von der Temperatur gesch tzt wird, kann Folgendes beobachtet werden:
• In jeder Phase (fest, fl ssig, gasf rmig) tendiert die Entropie dazu, mit steigender Temperatur leicht zu wachsen.
• Bei jedem Phasen bergang gibt es einen Sprung in der Entropie.
Dies kann wie folgt dargestellt werden:
Auf diese Weise kann die Entropie als ein Ma f r die Freiheitsgrade eines Systems verstanden werden. W hrend sie in einer Phase allm hlich zunimmt, weil nur wenige neue Freiheitsgrade freigesetzt werden, erfolgt bei Phasen berg ngen ein deutlicher Anstieg. Ein Festk rper besteht aus vielen Bindungen, die die Bewegung der Atome einschr nken. In einer Fl ssigkeit gehen viele Bindungen verloren, wodurch neue Freiheiten entstehen, die relative Bewegungen erm glichen und mit vielen neuen Freiheitsgraden verbunden sind. Schlie lich gehen bei bergang in den gasf rmigen Zustand alle Bindungen verloren, und jedes Teilchen hat drei Freiheitsgrade. Bei weiter steigender Temperatur k nnen die Teilchen rotieren und schwingen, was neue Freiheitsgrade und weitere Anstiege in der Entropie bedeutet.
Das dritte Gesetz der Thermodynamik besagt, dass sich die Entropie eines Systems dem Wert Null ann hert, wenn es auf den absoluten Nullpunkt gebracht wird. Dies kann wie folgt ausgedr ckt werden:
Der Differential ungenau Wärme ($\delta Q$) ist gleich die Absolute Temperatur ($T$) mal die Entropievariation ($dS$):
Wenn die Der Flüssigkeit oder dem Feststoff zugeführte Wärme ($\Delta Q$) zu einem K rper hinzugef gt wird, beobachten wir eine proportionale Zunahme von die Temperaturschwankungen ($\Delta T$). Daher k nnen wir eine Proportionalit tskonstante die Wärmekapazität ($C$) einf hren, die als W rmekapazit t bezeichnet wird und die folgende Beziehung festlegt:
Die Entropie ($S$) ist eine Funktion von die Absolute Temperatur ($T$) mit die Basisentropie ($S_0$) und die Basistemperatur ($T_0$) gem :
ID:(1468, 0)