Troisième loi de la thermodynamique
Storyboard 
La troisième loi de la thermodynamique stipule que, à mesure que la température approche du zéro absolu, l'entropie d'un système atteint une valeur constante. Généralement, cette constante est zéro, ce qui signifie qu'il n'existe qu'un seul état microscopique possible pour le système.
ID:(1468, 0)
Troisième loi de la thermodynamique
Storyboard 
La troisième loi de la thermodynamique stipule que, à mesure que la température approche du zéro absolu, l'entropie d'un système atteint une valeur constante. Généralement, cette constante est zéro, ce qui signifie qu'il n'existe qu'un seul état microscopique possible pour le système.
Variables
Calculs
Calculs
Équations
La relation de a variation de chaleur ($\delta Q$) avec a température absolue ($T$) et a variation d'entropie ($dS$) peut tre exprim e comme suit :
Lorsque nous combinons cela avec la relation entre a chaleur fournie au liquide ou au solide ($\Delta Q$), a chaleur spécifique de l'échantillon ($C$) et a variation de température ($\Delta T$) :
Nous obtenons cette relation dans la limite infinit simale, o :
$\delta Q = C dT = T dS$
Apr s int gration, cela nous conduit l' quation suivante :
avec la condition que a entropie de base ($S_0$) soit inf rieur a température de base ($T_0$).
Exemples
La troisi me loi de la thermodynamique stipule qu' mesure qu'un syst me approche du z ro absolu, l'entropie du syst me approche d'une valeur minimale. Au z ro absolu, l'entropie d'une substance parfaitement cristalline devient nulle. Cette loi implique qu'il est impossible d'atteindre le z ro absolu par une s rie finie de processus. La troisi me loi fournit galement un point de r f rence pour la d termination de l'entropie, garantissant que les valeurs d'entropie sont absolues et non relatives. Elle a des implications significatives pour le comportement des mat riaux des temp ratures tr s basses, influen ant des ph nom nes tels que la supraconductivit et la chaleur sp cifique des substances. En essence, la troisi me loi tablit une base pour l'entropie et souligne l'inaccessibilit du z ro absolu, mettant en avant les limitations inh rentes aux processus de refroidissement.
La troisi me loi de la thermodynamique [1] stipule qu' mesure que la a température absolue ($T$) d'un syst me approche du z ro absolu, la a entropie dans la limite de température nulle ($S$) d'une substance cristalline parfaite approche une valeur minimale, typiquement z ro. Cela implique qu'il est impossible d'atteindre le z ro absolu par un nombre fini de processus car l'entropie deviendrait constante. Essentiellement, la troisi me loi tablit que l'entropie d'un cristal parfait au z ro absolu est nulle et souligne l'inaccessibilit du z ro absolu en raison de la quantit infinie d' nergie n cessaire pour l'atteindre.
Cette loi a des implications significatives pour comprendre le comportement des mat riaux des temp ratures tr s basses et fournit un point de r f rence fondamental pour calculer les valeurs d'entropie.
![]() [1] " ber die Berechnung chemischer Gleichgewichte aus thermischen Messungen" (Sur le calcul des quilibres chimiques partir de mesures thermiques), Walther Nernst, Nachrichten von der Gesellschaft der Wissenschaften zu G ttingen, Mathematisch-Physikalische Klasse, 1906
[1] " ber die Berechnung chemischer Gleichgewichte aus thermischen Messungen" (Sur le calcul des quilibres chimiques partir de mesures thermiques), Walther Nernst, Nachrichten von der Gesellschaft der Wissenschaften zu G ttingen, Mathematisch-Physikalische Klasse, 1906
La relation de a variation de chaleur ($\delta Q$) avec a température absolue ($T$) et a variation d'entropie ($dS$) peut tre exprim e comme suit :
Lorsque nous combinons cela avec la relation entre a chaleur fournie au liquide ou au solide ($\Delta Q$), a chaleur spécifique de l'échantillon ($C$) et a variation de température ($\Delta T$) :
Nous obtenons cette relation dans la limite infinit simale, o :
$\delta Q = C dT = T dS$
Apr s int gration, cela nous conduit l' quation suivante :
avec la condition que a entropie de base ($S_0$) soit inf rieur a température de base ($T_0$).
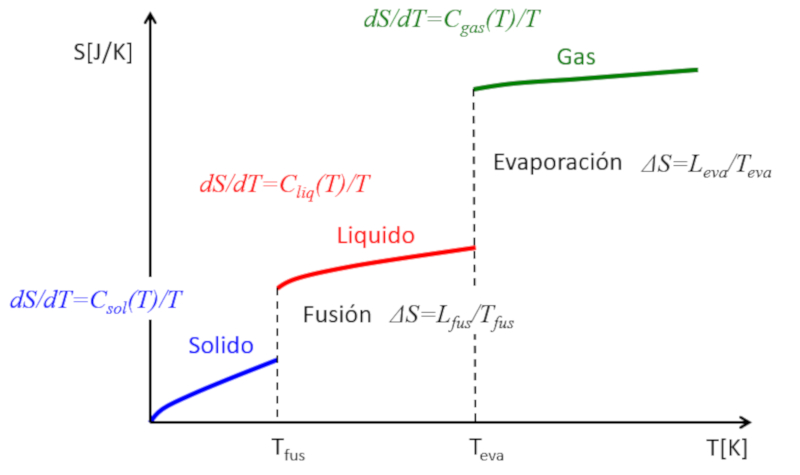
Si l'entropie est estim e en fonction de la temp rature, les observations suivantes peuvent tre faites :
• Dans chaque phase (solide, liquide, gazeux), l'entropie a tendance augmenter l g rement avec la temp rature.
• Lors de chaque transition de phase, il y a un saut significatif dans l\'entropie.
Cela peut tre repr sent de la mani re suivante :
Ainsi, on peut comprendre l\'entropie comme une mesure moyenne des degr s de libert qu\'un syst me poss de. Alors que dans chaque phase, l\'entropie augmente progressivement car quelques degr s de libert suppl mentaires sont \\"lib r s\\", lors des transitions de phase, l\'augmentation de l\'entropie est importante. Dans un solide, de multiples liaisons restreignent le mouvement des atomes, ce qui limite les degr s de libert . Dans un liquide, de nombreuses liaisons sont rompues, cr ant de nouvelles libert s qui permettent les mouvements relatifs et entra nent de nombreux nouveaux degr s de libert . Enfin, lors de la transition vers la phase gazeuse, toutes les liaisons sont perdues et chaque particule a ses trois degr s de libert . mesure que la temp rature augmente, les particules peuvent tourner et osciller, introduisant de nouveaux degr s de libert et des augmentations suppl mentaires de l\'entropie.
La troisi me loi de la thermodynamique stipule que lorsqu'un syst me est amen une temp rature absolue de z ro, son entropie tend vers z ro. Cela peut tre exprim de la mani re suivante:
Le différence de chaleur inexacte ($\delta Q$) est gal a température absolue ($T$) fois a variation d'entropie ($dS$)xa0:
Lorsque a chaleur fournie au liquide ou au solide ($\Delta Q$) sont ajout s un corps, nous observons une augmentation proportionnelle de a variation de température ($\Delta T$). Par cons quent, nous pouvons introduire une constante de proportionnalit a capacité calorique ($C$), appel e capacit thermique, qui tablit la relation suivante:
A entropie ($S$) est une fonction de a température absolue ($T$) avec a entropie de base ($S_0$) et a température de base ($T_0$) selonxa0:
ID:(1468, 0)