Relación Adiabática de Volumen - Temperatura
Storyboard
En el caso de procesos adiabaticos existe una relación equivalente a la ley de Charles que relacionan volumen $V$ y temperatura absoluta $T$ que incluye un coeficiente adiabático.
ID:(1481, 0)
Cambio de temperatura en un proceso adiábatico
Concepto
Cuando un gas se expande rápidamente, las moléculas de vapor de agua no tienen tiempo suficiente para intercambiar energía entre sí, lo que resulta en un proceso sin cambio en la energía interna, es decir, la variación de la Energía Interna ($dU$) se mantiene constante:
$dU = 0$
La expansión del gas requiere que el sistema realice trabajo o genere el diferencial inexacto del trabajo ($\delta W$). Sin embargo, la energía necesaria para esto no puede provenir de la energía interna ($U$), por lo que se debe obtener del calor. Como resultado, la temperatura del sistema disminuye, lo que se refleja en una reducción de la variación de calor ($\delta Q$).
Un ejemplo típico de este proceso es la formación de nubes. Cuando el aire asciende por convección, se expande y realiza trabajo, lo que provoca un enfriamiento. La humedad presente en el aire se condensa, formando nubes.
Por otro lado, cuando se realiza trabajo sobre el sistema, se realiza un trabajo positivo el diferencial inexacto del trabajo ($\delta W$), pero como la energía interna ($U$) no puede aumentar, la energía térmica en la variación de calor ($\delta Q$) aumenta, lo que significa un aumento en la temperatura del sistema.
Un ejemplo común de este proceso es el funcionamiento de una bomba. Si intentamos inflar algo rápidamente, realizamos trabajo sobre el sistema de manera adiabática, lo que resulta en un aumento de la variación de calor ($\delta Q$) y, por lo tanto, en un aumento de la temperatura del sistema.
ID:(41, 0)
Comparación diagrama VT isobárico y adiabático
Concepto
Cuando comparamos la relación entre la temperatura absoluta ($T$) y el volumen ($V$) en el caso isotérmico (donde "iso" significa igual y "barico" se refiere a la presión), obtenemos la siguiente ecuación para la temperatura en estado inicial ($T_i$), la temperatura en estado final ($T_f$), el volumen en estado i ($V_i$) y el volumen en estado f ($V_f$):
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
En el caso adiabático, esta ecuación debe satisfacerse con el indice adiabático ($\kappa$), lo que nos lleva a la siguiente ecuación:
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Si consideramos $\kappa=1,4$, esto se puede observar gráficamente en la siguiente representación:
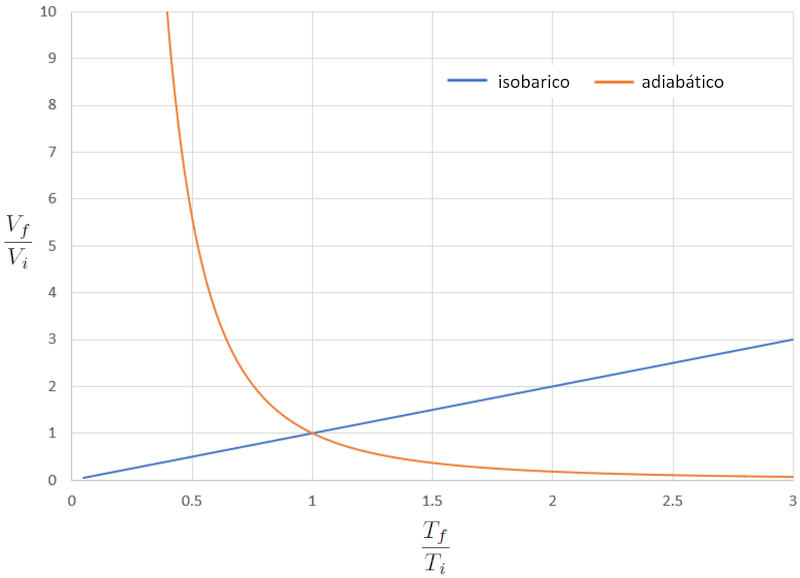
La gran diferencia en el comportamiento de un gas en un proceso isobárico en comparación con un proceso adiabático es que, en el primer caso, si un sistema se expande, la temperatura aumenta, mientras que en el segundo caso, disminuye.
ID:(11172, 0)
Formación de nubes por expansión adiabática
Concepto
Si se coloca agua en una botella y se bombea aire para aumentar la presión, se obtiene aire con alta humedad a presión elevada. Si se abre la botella al exterior, el aire se expande, lo que provoca una reducción de la temperatura y lleva al aire a su punto de saturación, dando lugar a la formación de vapor de agua y la aparición de una nube.
Cloud in a Bottle - Sick Science! #076 (https://www.youtube.com/watch?v=LHjDT9pYxRA)
ID:(11222, 0)
Condición adiabatica
Ecuación
En el caso adiabático, el sistema no tiene la capacidad de cambiar la energía interna ($U$), es decir, la variación de la Energía Interna ($dU$) debe ser nulo:
ID:(4860, 0)
Relación caso adiabático de temperatura y volumen
Ecuación
Dado que la ecuación para el proceso adiabático en temperatura absoluta ($T$) y el volumen ($V$) con la constante universal de los gases ($R$), la masa molar ($M_m$), el calor especifico a presión constante ($c_p$), la variación de la temperatura ($dT$) y la variación del volumen ($dV$) es la siguiente:
| $\displaystyle\frac{ dT }{ T }=-\displaystyle\frac{ R }{ M_m c_p }\displaystyle\frac{ dV }{ V }$ |
Podemos reemplazar las constantes con el indice adiabático ($\kappa$) e integrar en temperatura absoluta ($T$) y el volumen ($V$) desde el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$) para obtener:
En el caso adiabático, para temperatura absoluta ($T$) y el volumen ($V$) con la constante universal de los gases ($R$), la masa molar ($M_m$), el calor especifico a presión constante ($c_p$), la variación de la temperatura ($dT$) y la variación del volumen ($dV$), se tiene la siguiente ecuación:
| $\displaystyle\frac{ dT }{ T }=-\displaystyle\frac{ R }{ M_m c_p }\displaystyle\frac{ dV }{ V }$ |
Al introducir el indice adiabático ($\kappa$), esta ecuación se puede expresar como:
| $ \kappa =1+\displaystyle\frac{ R }{ M_m c_V }$ |
Lo que nos permite escribir la ecuación como:
$\displaystyle\frac{dT}{T}=-(\kappa - 1)\displaystyle\frac{dV}{V}$
Si integramos esta expresión entre el volumen en estado i ($V_i$) y el volumen en estado f ($V_f$), así como entre la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$), obtenemos:
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Es importante tener en cuenta que esta ecuación es adicional a la ecuación general de los gases ideales, ya que representa una restricción adicional impuesta por la condición de que la energía interna no cambia.
ID:(4865, 0)
Video: Relación adiabática de volumen - temperatura
Video
Mini clase que explica los conceptos y el desarrollo de las ecuaciones claves del tema.
ID:(11226, 0)
0
Video
Video: Relación adiabática de volumen - temperatura
