Difusión
Storyboard
Cuando existen variaciones en la concentración de un gas ocurre el fenómeno de difusión que tiende a reducir las variaciones. Este ocurre simplemente porque es mas probable que una molécula se desplace de una zona de mayor concentración a una de menor que a la inversa simplemente por el numero de moléculas existentes.
ID:(1311, 0)
Presión
Concepto
La presión es el resultado de las múltiples colisiones de las partículas del gas con las paredes del recipiente. Cada colisión contribuye a la presión total ejercida por el gas. Cuanto más rápido se muevan las partículas y cuantas más colisiones ocurran en un período de tiempo determinado, mayor será la presión.
ID:(9599, 0)
Moles
Concepto
Al emplear el concepto de mol, podemos establecer una relación directa entre la cantidad de sustancia de un gas y la cantidad de partículas de el número de partículas ($N$) presentes en él. Esto simplifica los cálculos y permite una conexión más intuitiva entre la cantidad de gas y las propiedades que lo describen, tales como la presión ($p$), el volumen ($V$) y la temperatura absoluta ($T$).
La constante el número de Avogadro ($N_A$), que es aproximadamente igual a $6,02\times 10^{23}$, representa una constante fundamental en la química y se utiliza para realizar conversiones entre la escala macroscópica y la escala microscópica de los átomos y las moléculas.
ID:(9600, 0)
Ley de Charles
Hipótesis
En 1780 Jacques Charles descubrió que a y en un el Volumen
| $\displaystyle\frac{ V }{ T }= cte $ |
En este caso si la entonces el .
ID:(9518, 0)
Cambio de estado de un gas ideal según la ley de Charles
Ecuación
La ley de Charles establece que con la presión ($p$) constante se cumple la siguiente relación entre la temperatura absoluta ($T$) y el volumen ($V$):
| $\displaystyle\frac{ V }{ T }= cte $ |
Esto significa que si un gas pasa de un estado inicial (i) a un estado final (f) con la presión ($p$) y el número de partículas ($N$) constantes, esto ocurre de modo que con el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$), y la temperatura en estado final ($T_f$) se cumple:
ID:(3492, 0)
Relación temperatura vs presión
Descripción
En un gas, cuando se mantienen constantes el volumen ($V$) y el número de partículas ($N$), se observa que la presión ($p$) y la temperatura absoluta ($T$) varían de manera proporcional. Cuando la temperatura absoluta ($T$) disminuye, la presión ($p$) también disminuye, y viceversa, como se ilustra en el siguiente gráfico:
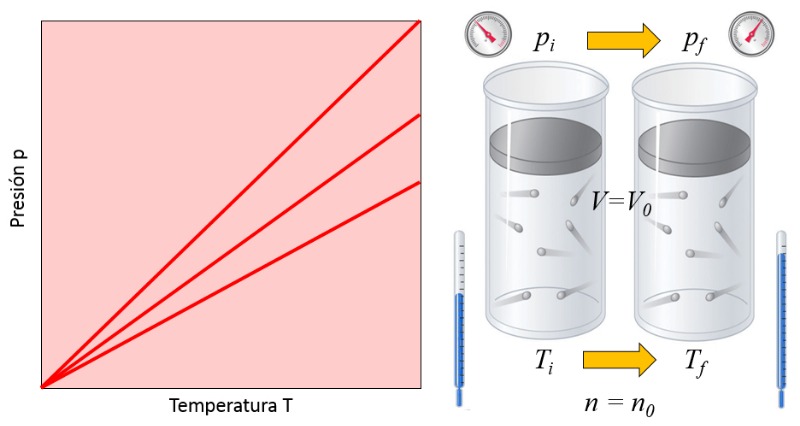
ID:(9530, 0)
Ley de Gay Lussac
Hipótesis
Alrededor de 1808 Joseph Louis Gay-Lussac, en conjunto con otros cientificos, descubrió que a y en un la Presión
| $\displaystyle\frac{p}{T}=cte$ |
En este caso si la entonces la .
ID:(9519, 0)
Cambio de estado de un gas ideal según la ley de Gay Lussac
Ecuación
La Ley de Gay-Lussac establece que, manteniendo constante el volumen ($V$), se cumple la siguiente relación entre la temperatura absoluta ($T$) y la presión ($p$):
| $\displaystyle\frac{p}{T}=cte$ |
Esto significa que si un gas pasa de un estado inicial (i) a un estado final (f) con la presión ($p$) y el número de partículas ($N$) constantes, esto ocurre de tal manera que con la presión en estado inicial ($p_i$), la presión en estado final ($p_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$) se cumple:
ID:(3490, 0)
Relación temperatura vs volumen
Descripción
En un gas, si se mantiene constante la presión ($p$) y el número de partículas ($N$), se observa que el volumen ($V$) y la temperatura absoluta ($T$) varían de forma proporcional. Cuando el volumen ($V$) disminuye, la temperatura absoluta ($T$) también disminuye, y viceversa, como se ilustra en el siguiente gráfico:
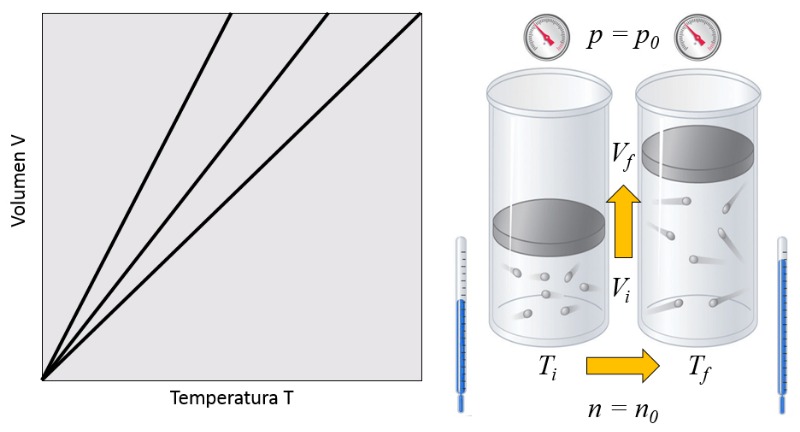
ID:(9529, 0)
Ley de Boyle
Hipótesis
En 1662 Robert Boyle descubrió que a y en un la Presión
| $ p V = cte$ |
En este caso si el entonces la .
ID:(9520, 0)
Cambio de estado de un gas ideal según la ley de Boyle
Ecuación
La ley de Boyle establece que con la temperatura absoluta ($T$) constante se cumple que para la presión ($p$) y el volumen ($V$) la siguiente relación:
| $ p V = cte$ |
Esto significa que si un gas pasa de un estado inicial (i) a un estado final (f) con la temperatura absoluta ($T$) constante, de modo que para la presión en estado inicial ($p_i$), la presión en estado final ($p_f$), el volumen en estado i ($V_i$), y el volumen en estado f ($V_f$) se cumple la siguiente relación:
ID:(3491, 0)
Relación volumen y presión
Descripción
En un gas, si se mantienen la temperatura absoluta ($T$) y el número de partículas ($N$) constantes, se observa que el volumen ($V$) y la presión ($p$) varían de forma inversamente proporcional. Cada vez que se reduce el volumen ($V$), se observa que la presión ($p$) aumenta y viceversa, como se ilustra en el siguiente gráfico:
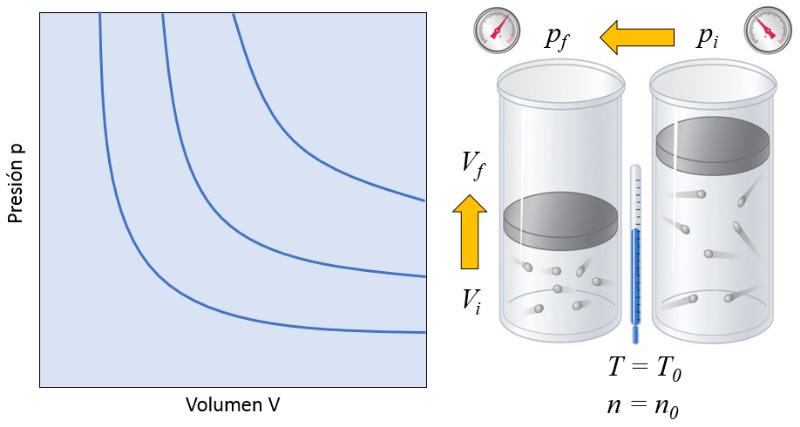
ID:(9531, 0)
Ley de Avogadro
Hipótesis
En 1811 Amedeo Avogadro postula que a y en un el Numero de moles
| $\displaystyle\frac{n}{V}=cte$ |
En este caso si el entonces el .
ID:(9521, 0)
Cambio de estado de un gas ideal según la ley de Avogadro
Ecuación
La ley de Avogadro se expresa mediante la relación de el número de moles ($n$), el volumen ($V$) y la constante del principio de Avogadro ($C_{nV}$) de la siguiente manera:
| $\displaystyle\frac{n}{V}=cte$ |
Esto significa que si tenemos un gas en un estado inicial (i) y lo llevamos a un estado final (f) manteniendo la presión ($p$) y la temperatura absoluta ($T$) constantes, la relación entre el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), el número de moles en estado i ($n_i$) y el número de moles en estado f ($n_f$) es la siguiente:
ID:(3489, 0)
Concentración molar
Ecuación
La concentración molar ($c_m$) corresponde al número de moles ($n$) por el volumen ($V$) de un gas y se calcula como sigue:
ID:(4878, 0)
Relación moles y volumen
Descripción
En un gas, cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$), se observa una variación proporcional entre el volumen ($V$) y el número de moles ($n$). Cada vez que el volumen ($V$) aumenta, se nota un aumento correspondiente en el número de moles ($n$), y viceversa, como se ilustra en el siguiente gráfico:
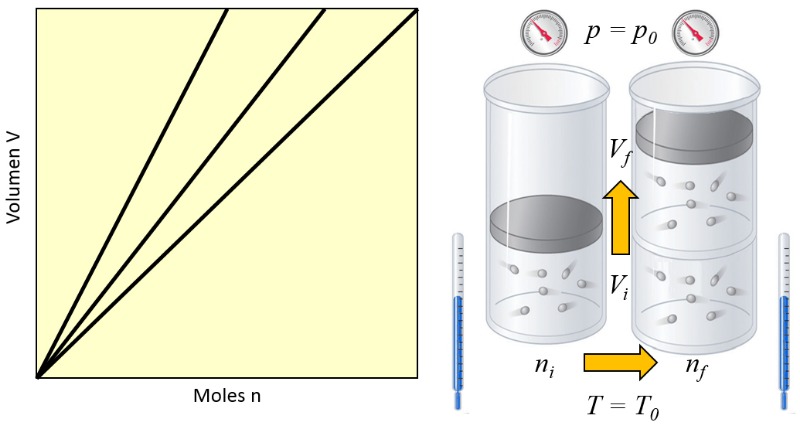
ID:(9532, 0)
Ley General de los Gases
Ecuación
En 1834, Émile Clapeyron reconoció que la presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$) se relacionan mediante la ley de Boyle, la ley de Charles, la ley de Gay-Lussac y la ley de Avogadro. Estas leyes se pueden reescribir en la forma:
La presión ($p$), el volumen ($V$), la temperatura absoluta ($T$) y el número de moles ($n$) están vinculados a través de las siguientes leyes físicas:
• La ley de Boyle
| $ p V = C_{pV} $ |
• La ley de Charles
| $\displaystyle\frac{ V }{ T } = C_{VT}$ |
• La ley de Gay-Lussac
| $\displaystyle\frac{ p }{ T } = C_{pT}$ |
• La ley de Avogadro
| $\displaystyle\frac{ n }{ V } = C_{nV} $ |
Estas leyes pueden ser expresadas de manera más general como:
$\displaystyle\frac{pV}{nT}=cte$
Esta relación general establece que el producto de la presión y el volumen dividido por el número de moles y la temperatura se mantiene constante:
| $ p V = n R T $ |
En esta ecuación, la constante universal de los gases ($R$) asume el valor 8.314 J/K·mol.
ID:(3183, 0)
Integrando las leyes de los gases
Descripción
Las tres leyes de los gases que relacionan la presión ($p$), el volumen ($V$) y la temperatura absoluta ($T$) son:
• La ley de Boyle, que establece que a temperatura constante, el producto de la presión y el volumen de un gas es constante:
| $ p V = C_{pV} $ |
• La ley de Charles, que establece que a presión constante, el volumen de un gas es directamente proporcional a su temperatura absoluta:
| $\displaystyle\frac{ V }{ T } = C_{VT}$ |
• La ley de Gay-Lussac, que establece que a volumen constante, la presión de un gas es directamente proporcional a su temperatura absoluta:
| $\displaystyle\frac{ p }{ T } = C_{pT}$ |
Estas leyes se pueden representar gráficamente como se muestra en la siguiente imagen:
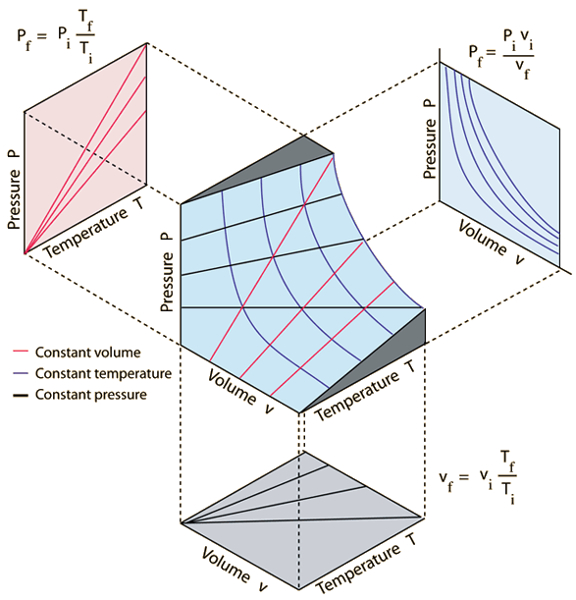
Diagram presión, volumen, temperatura de un gas ideal (http://hyperphysics.phy-astr.gsu.edu)
ID:(9525, 0)
