Loi de Boyle-Mariotte
Storyboard 
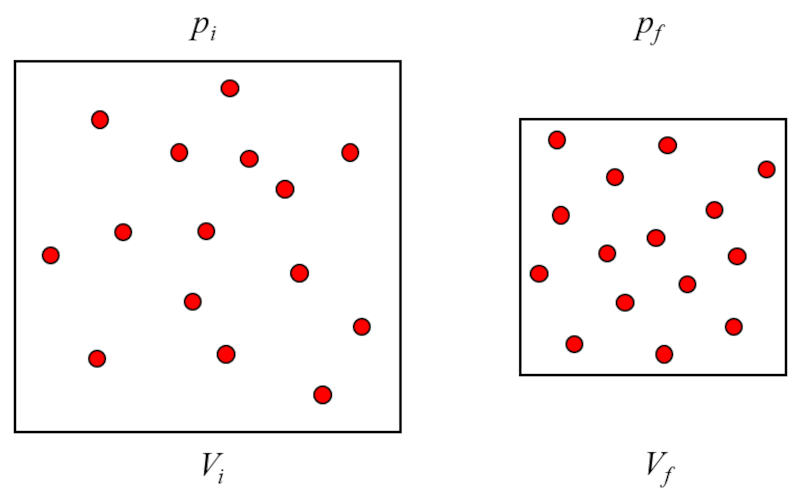
La loi de Boyle-Mariotte établit que le produit de a pression ($p$) et le volume ($V$) d'un gaz reste constant lorsque la température absolue et la quantité de matière ne varient pas.
Cela signifie que a pression ($p$) varie de manière inversement proportionnelle à Le volume ($V$).
ID:(1472, 0)
Loi de Boyle-Mariotte
Storyboard 
La loi de Boyle-Mariotte établit que le produit de 5224 et 5226 d'un gaz reste constant lorsque la température absolue et la quantité de matière ne varient pas. Cela signifie que 5224 varie de manière inversement proportionnelle à 5226.
Variables
Calculs
Calculs
Équations
La loi de Boyle stipule que, avec a température absolue ($T$) constant, le produit de a pression ($p$) et le volume ($V$) est gal a constante de la loi de Boyle ($C_b$) :
Cela signifie que si un gaz passe d'un tat initial (a pression à l'état initial ($p_i$) et le volume à l'état i ($V_i$)) un tat final (a pression à l'état final ($p_f$) et le volume à l'état f ($V_f$)), en maintenant a température absolue ($T$) constant, il doit toujours respecter la loi de Boyle :
$p_i V_i = C_b = p_f V_f$
Par cons quent, on a :
Si, dans un changement isotherme o le contenu ne varie pas, a pression à l'état initial ($p_i$), a pression à l'état final ($p_f$), le volume à l'état i ($V_i$) et le volume à l'état f ($V_f$) sont li s par :
Alors, nous pouvons introduire a densité ($\rho$) qui, avec a masse ($M$) et le volume ($V$), satisfait :
Ce qui nous am ne a densité dans l'état i ($\rho_i$) et a densité dans l'état f ($\rho_f$) comme suit :
Exemples
La loi de Boyle-Mariotte, galement connue sous le nom de loi de Boyle, d crit la relation inverse entre la pression et le volume d'un gaz temp rature constante. Elle stipule que, pour une quantit fixe de gaz, lorsque la temp rature est maintenue constante, la pression du gaz augmente mesure que le volume diminue, et vice-versa. Cela signifie que si vous compressez un gaz en r duisant son volume, sa pression augmentera proportionnellement, et si vous augmentez le volume, la pression diminuera proportionnellement. Cette relation est fondamentale pour comprendre le comportement des gaz et s'exprime math matiquement par le produit de la pression et du volume tant une constante pour une quantit de gaz donn e temp rature constante.
A pression ($p$) est g n r lorsque les particules de gaz entrent en collision avec la surface du contenant de gaz. Comme a température absolue ($T$) est constant, l' nergie des particules ne varie pas et les chocs de celles-ci avec les surfaces du contenant de gaz ne varieront pas dans le transfert d'impulsion. Cependant, le nombre d'impacts d pend du nombre de particules pr s de la surface, qui son tour est proportionnel au a concentration de particules ($c_n$) du gaz.
D'autre part, la densit est inversement proportionnelle le volume ($V$), ce qui conduit la relation suivante :
$p \propto c_n \propto \displaystyle\frac{1}{V}$
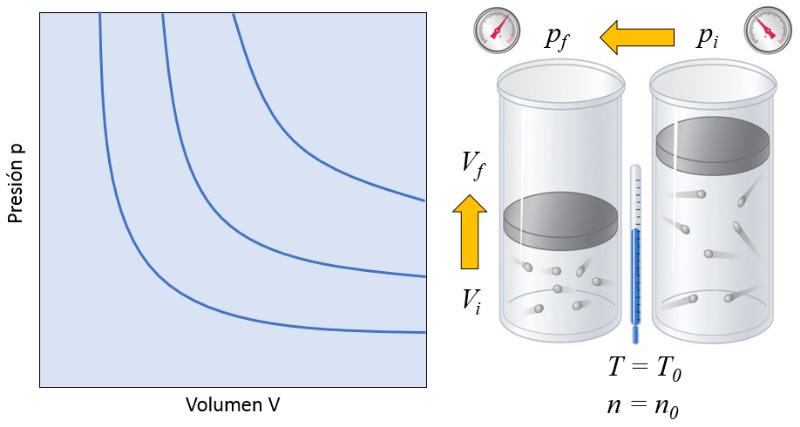
Dans un gaz, si la fois a température absolue ($T$) et le nombre de particules ($N$) sont maintenus constants, on observe que le volume ($V$) et a pression ($p$) varient de mani re inversement proportionnelle. Chaque fois que le volume ($V$) est r duit, a pression ($p$) augmente, et vice versa,
$p \propto \displaystyle\frac{1}{V}$
comme illustr dans le graphique suivant :
La relation entre le nombre de particules ($N$) et a température absolue ($T$) est que leur produit est gal une constante de la loi de Boyle ($C_b$), ce qui correspond la loi de Boyle [1], en l'honneur de son d couvreur Robert Boyle :
On parle parfois de la loi de Boyle-Mariotte, en souvenir du physicien fran ais Edme Mariotte qui a d couvert la m me loi de mani re ind pendante en 1676.
![]() [1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Nouveaux essais physico-m caniques, concernant la r silience de l'air et ses effets), Robert Boyle, Oxford : imprim par H. Hall, imprimeur de l'universit , pour Tho. Robinson (1660).
[1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Nouveaux essais physico-m caniques, concernant la r silience de l'air et ses effets), Robert Boyle, Oxford : imprim par H. Hall, imprimeur de l'universit , pour Tho. Robinson (1660).
Robert Boyle tait un scientifique irlandais n en 1627. Il est consid r comme l'un des fondateurs de la chimie moderne et est connu pour ses contributions dans le domaine du comportement des gaz. La relation entre Robert Boyle et la loi de Boyle vient du fait qu'il a formul cette loi au XVIIe si cle. La loi de Boyle tablit que, temp rature constante, le volume d'un gaz est inversement proportionnel sa pression. Boyle a r alis des exp riences qui ont d montr cette relation et jet les bases de la compr hension du comportement des gaz.
La loi de Boyle stipule que, avec a température absolue ($T$) constant, le produit de a pression ($p$) et le volume ($V$) est gal a constante de la loi de Boyle ($C_b$) :
Cela signifie que si un gaz passe d'un tat initial (a pression à l'état initial ($p_i$) et le volume à l'état i ($V_i$)) un tat final (a pression à l'état final ($p_f$) et le volume à l'état f ($V_f$)), en maintenant a température absolue ($T$) constant, il doit toujours respecter la loi de Boyle :
$p_i V_i = C_b = p_f V_f$
Par cons quent, on a :
Si, dans un changement isotherme o le contenu ne varie pas, a pression à l'état initial ($p_i$), a pression à l'état final ($p_f$), le volume à l'état i ($V_i$) et le volume à l'état f ($V_f$) sont li s par :
Alors, nous pouvons introduire a densité ($\rho$) qui, avec a masse ($M$) et le volume ($V$), satisfait :
Ce qui nous am ne a densité dans l'état i ($\rho_i$) et a densité dans l'état f ($\rho_f$) comme suit :
La loi de Boyle tablit une relation entre le volume ($V$) et a pression ($p$), en indiquant que leur produit est gal a constante de la loi de Boyle ($C_b$), de la mani re suivante :
La loi de Boyle tablit une relation entre le volume ($V$) et a pression ($p$), en indiquant que leur produit est gal a constante de la loi de Boyle ($C_b$), de la mani re suivante :
Si un gaz passe d'un tat initial (i) un tat final (f) avec a température absolue ($T$) constant, la relation suivante est valable pour a pression à l'état initial ($p_i$), a pression à l'état final ($p_f$), le volume à l'état i ($V_i$) et le volume à l'état f ($V_f$) :
La loi de Boyle pour l' tat initial (a densité dans l'état i ($\rho_i$), a pression à l'état initial ($p_i$)) et l' tat final (a densité dans l'état f ($\rho_f$), a pression à l'état final ($p_f$)) s'exprime comme suit :
ID:(1472, 0)