Princípio de Avogadro
Storyboard 
O princípio de Avogadro estabelece que a divisão de o número de moles ($n$) por o volume ($V$) é constante, enquanto la pressão ($p$) e la temperatura absoluta ($T$) são constantes.
Isso significa que o número de moles ($n$) varia proporcionalmente a o volume ($V$).
ID:(1475, 0)
Princípio de Avogadro
Storyboard 
O princípio de Avogadro estabelece que a divisão de 9339 por 5226 é constante, enquanto 5224 e 5177 são constantes. Isso significa que 9339 varia proporcionalmente a 5226.
Variáveis
Cálculos
Cálculos
Equações
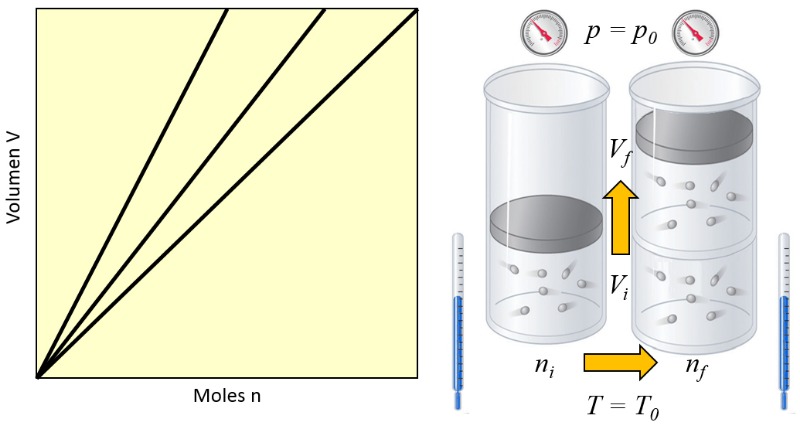
O princ pio de Avogadro estabelece que quando la pressão ($p$) e la temperatura absoluta ($T$) s o mantidos constantes, a propor o de ERROR:6679 para o volume ($V$) igual a la constante do princípio de Avogadro ($C_a$):
Isso significa que se um g s passa de um estado inicial (o número de moles no estado i ($n_i$) e o volume no estado i ($V_i$)) para um estado final (o número de moles no estado f ($n_f$) e o volume no estado f ($V_f$)) mantendo la pressão ($p$) e la temperatura absoluta ($T$) constantes, a lei de Gay-Lussac sempre deve ser cumprida:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Portanto, temos:
Exemplos
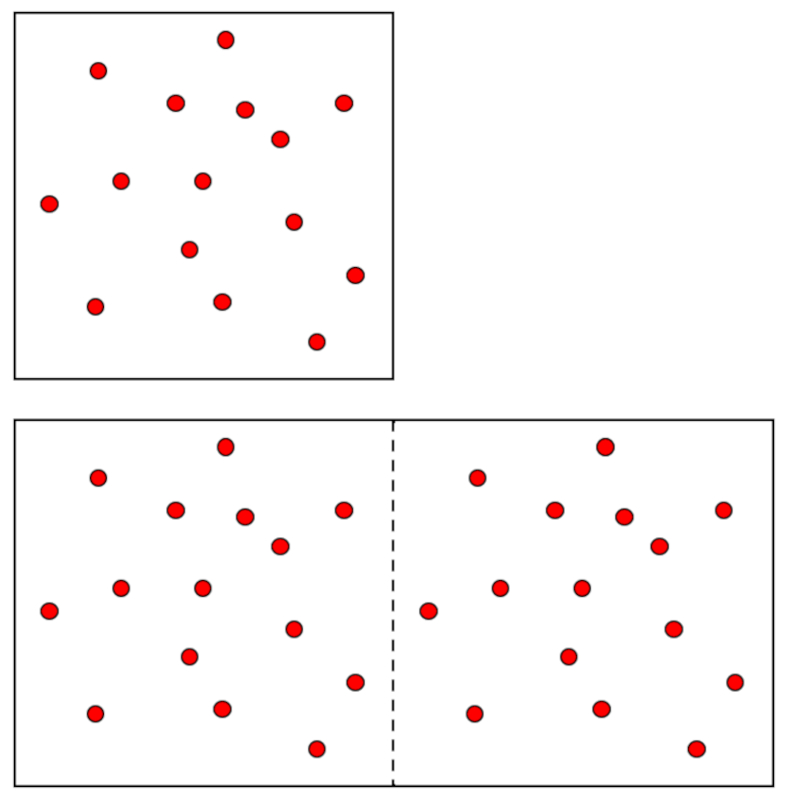
O princ pio de Avogadro estabelece que volumes iguais de gases, mesma temperatura e press o, cont m o mesmo n mero de mol culas. Isso significa que o volume de um g s diretamente proporcional ao n mero de mol culas (ou mols) presentes quando a temperatura e a press o s o mantidas constantes. Este princ pio fundamental para entender o comportamento dos gases e forma a base da lei dos gases ideais. Ele permite determinar a quantidade de g s em um determinado volume e essencial para c lculos que envolvem rea es qu micas e misturas de gases.
Existem vari veis intensivas e extensivas. As primeiras s o caracter sticas do estado do sistema e n o dependem do tamanho deste. Dois exemplos s o la pressão ($p$) e la temperatura absoluta ($T$). Se desejamos um sistema maior que este em um mesmo estado, tanto la pressão ($p$) quanto la temperatura absoluta ($T$) devem permanecer iguais.
A situa o diferente com o volume ($V$), que uma vari vel extensiva, ou seja, se for necess rio um sistema maior, ela ter que aumentar na propor o correspondente. O mesmo ocorre com o número total de moles ($n$):
Al m disso, ambas devem aumentar na mesma propor o, ent o, se la pressão ($p$) e la temperatura absoluta ($T$) forem constantes, ser o proporcionais entre si:
$n \propto V$
Em um g s, quando as constantes la pressão ($p$) e la temperatura absoluta ($T$) s o mantidas, observa-se uma rela o proporcional entre o volume ($V$) e o número de moles ($n$). Cada vez que o volume ($V$) aumenta, observado que o número de moles ($n$) tamb m aumenta, e vice-versa,
$n \propto V$
como mostrado no gr fico a seguir:
A Lei de Avogadro [1] afirma que o volume ($V$) e o número de moles ($n$) s o diretamente proporcionais quando la pressão ($p$) e la temperatura absoluta ($T$) s o mantidos constantes.
Essa rela o pode ser expressa da seguinte forma, usando la constante do princípio de Avogadro ($C_a$):
![]() [1] "Ensaio sobre um M todo para Determinar as Massas Relativas das Mol culas Elementares dos Corpos e as Propor es nas Quais Elas Entram em Suas Combina es," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
[1] "Ensaio sobre um M todo para Determinar as Massas Relativas das Mol culas Elementares dos Corpos e as Propor es nas Quais Elas Entram em Suas Combina es," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
Amadeo Avogadro, cujo nome completo era Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto, foi um cientista italiano nascido em 9 de agosto de 1776 e falecido em 9 de julho de 1856. Avogadro conhecido principalmente por suas contribui es para o desenvolvimento da teoria molecular e a formula o da lei de Avogadro. Ele prop s que volumes iguais de gases, mesma temperatura e press o, cont m o mesmo n mero de part culas, o que conhecido como o princ pio de Avogadro ou a lei de Avogadro. Esse conceito foi fundamental para o desenvolvimento do conceito de mol cula e estabeleceu as bases para entender as rela es entre a quantidade de subst ncia, o volume e o n mero de part culas em gases. Apesar de suas importantes contribui es, o trabalho de Avogadro n o foi amplamente reconhecido durante sua vida, e suas ideias ganharam maior aceita o anos ap s sua morte. Atualmente, Avogadro homenageado por suas contribui es fundamentais para a qu mica e considerado um dos pioneiros da teoria molecular moderna.
O princ pio de Avogadro estabelece que quando la pressão ($p$) e la temperatura absoluta ($T$) s o mantidos constantes, a propor o de ERROR:6679 para o volume ($V$) igual a la constante do princípio de Avogadro ($C_a$):
Isso significa que se um g s passa de um estado inicial (o número de moles no estado i ($n_i$) e o volume no estado i ($V_i$)) para um estado final (o número de moles no estado f ($n_f$) e o volume no estado f ($V_f$)) mantendo la pressão ($p$) e la temperatura absoluta ($T$) constantes, a lei de Gay-Lussac sempre deve ser cumprida:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Portanto, temos:
A Lei de Avogadro afirma que o volume ($V$) e o número de moles ($n$) s o diretamente proporcionais quando la pressão ($p$) e la temperatura absoluta ($T$) s o mantidos constantes.
Essa rela o pode ser expressa da seguinte forma, usando la constante do princípio de Avogadro ($C_a$):
A Lei de Avogadro afirma que o volume ($V$) e o número de moles ($n$) s o diretamente proporcionais quando la pressão ($p$) e la temperatura absoluta ($T$) s o mantidos constantes.
Essa rela o pode ser expressa da seguinte forma, usando la constante do princípio de Avogadro ($C_a$):
Se um g s passa de um estado inicial (i) para um estado final (f) mantendo constantes la pressão ($p$) e la temperatura absoluta ($T$), ent o para o número de moles no estado i ($n_i$), o volume no estado i ($V_i$), o número de moles no estado f ($n_f$) e o volume no estado f ($V_f$) temos:
ID:(1475, 0)