Entropia
Storyboard 
A entropia é a parte da energia em um sistema que não pode ser utilizada para realizar trabalho. Do ponto de vista microscópico, está relacionada com o número de possíveis configurações que o sistema pode assumir. Um maior número dessas configurações está associado a um aumento na desordem do sistema e a uma diminuição na probabilidade de que ele retorne a um estado anterior, reduzindo assim a possibilidade de reversibilidade do sistema.
ID:(1471, 0)
Entropia
Storyboard 
A entropia física é um conceito fundamental na termodinâmica e na mecânica estatística que representa o grau de desordem ou aleatoriedade em um sistema. Ela mede o número de maneiras específicas pelas quais um sistema termodinâmico pode ser organizado, refletindo a quantidade de incerteza ou o número de possíveis microestados correspondentes a um dado macroestado. A entropia quantifica a desordem, sendo que uma maior entropia indica maior desordem. De acordo com a segunda lei da termodinâmica, a entropia de um sistema isolado nunca diminui, o que significa que os processos naturais tendem a se mover para um estado de entropia máxima ou desordem. A entropia também mede a irreversibilidade dos processos, onde processos espontâneos aumentam a entropia do universo. Ela é um fator chave para determinar a eficiência de motores térmicos e refrigeradores, entender o comportamento de sistemas biológicos e estudar a evolução do universo. Essencialmente, a entropia é uma medida da imprevisibilidade e da dispersão de energia em um sistema, fornecendo insights sobre a tendência natural para a desordem e as limitações na conversão de energia.
Variáveis
Cálculos
Cálculos
Equações
Exemplos
Para compreender melhor o conceito de entropia, podemos imaginar um sistema no estado s lido, onde os tomos est o organizados de forma ordenada e a entropia baixa.
medida que fornecemos energia ao sistema, os tomos come am a oscilar com mais intensidade, e a ordem come a a se perder. Ao atingir a temperatura de fus o, algumas part culas s o libertadas de suas posi es fixas e ganham mais liberdade de movimento dentro da matriz do material. Esse aumento de desordem faz com que a entropia cres a.
Se continuarmos fornecendo energia at alcan ar a temperatura de ebuli o, as part culas come am a escapar do sistema, entrando no estado gasoso. Este o estado com maior liberdade e desordem molecular e, portanto, o de maior entropia. Quando o sistema se evapora completamente, atinge sua entropia m xima neste processo.
Se considerarmos a equa o de ERROR:5221,0 com la força mecânica ($F$) e o distância percorrida ($dx$):
na sua forma de la pressão ($p$) e o volume ($V$):
O trabalho desempenha o papel de um potencial, enquanto la pressão ($p$) age como uma 'for a generalizada', e o volume ($V$) serve como o caminho, uma esp cie de 'vari vel independente'. Se organizarmos esses conceitos em uma matriz para os par metros que discutimos at agora, obtemos:
| Potencial termodin mico | For a generalizada | Vari vel independente |
| Extensiva | Intensiva | Extensiva |
| $\delta W$ | $p$ | $dV$ |
| $\delta Q$ | $T$ | $?$ |
Nesse contexto, vemos que para a linha la variação de calor ($\delta Q$), temos a vari vel la temperatura absoluta ($T$), mas falta-nos uma vari vel independente extensiva. A esta chamamos de entropia e a denotamos com a letra $S$.
Existem vari veis que est o associadas a quantidades e outras que est o associadas a propriedades.
• As primeiras s o chamadas de vari veis extensivas, pois podem ser estendidas ou aumentadas em propor o quantidade de subst ncia presente. Exemplos de vari veis extensivas incluem volume, massa, carga el trica, calor, entre outros.
• Por outro lado, as segundas s o chamadas de vari veis intensivas, que representam propriedades que n o dependem da quantidade de subst ncia presente. Essas propriedades n o se alteram quando a quantidade de subst ncia alterada. Exemplos de vari veis intensivas incluem densidade, press o, temperatura, entre outros.
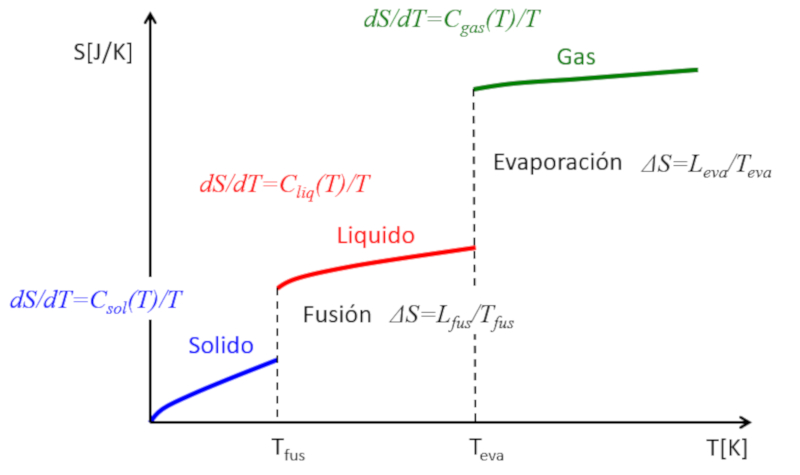
Se a entropia for estimada em fun o da temperatura, as seguintes observa es podem ser feitas:
• Em cada fase (s lido, l quido, gasoso), a entropia tende a aumentar ligeiramente com a temperatura.
• Durante as transi es de fase, ocorre um salto significativo na entropia.
Isso pode ser representado da seguinte forma:
Dessa maneira, a entropia pode ser compreendida como uma medida m dia dos graus de liberdade que um sistema possui. Enquanto em cada fase a entropia aumenta gradualmente devido libera o de alguns graus de liberdade adicionais, nas transi es de fase o aumento dram tico. Um s lido composto por m ltiplas liga es que restringem o movimento dos tomos, resultando em poucos graus de liberdade. Em um l quido, muitas liga es s o rompidas, criando novas liberdades que permitem o movimento relativo, levando a m ltiplos novos graus de liberdade. Finalmente, na transi o para a fase gasosa, todas as liga es s o perdidas e cada part cula possui seus tr s graus de liberdade. medida que a temperatura aumenta, as part culas podem rotacionar e oscilar, introduzindo novos graus de liberdade e incrementos adicionais na entropia.
Se considerarmos dois sistemas id nticos, um com uma temperatura $T_1$ e o outro com uma temperatura $T_2$, suas entropias podem ser calculadas usando a seguinte equa o envolvendo la entropia ($S$), la temperatura absoluta ($T$), la calor específico da amostra ($C$), la entropia básica ($S_0$) e la temperatura base ($T_0$):
Portanto, as entropias ser o:
$S_1 = S_0 + C\log\left(\displaystyle\frac{T_1}{T_0}\right)$
e
$S_2 = S_0 + C\log\left(\displaystyle\frac{T_2}{T_0}\right)$
Se ambos os sistemas forem misturados, sua temperatura ser a temperatura m dia:
$T_m=\displaystyle\frac{1}{2}(T_1+T_2)$
Portanto, a entropia do novo sistema ser :
$S_{1+2}=2S_0+2C\log\left(\displaystyle\frac{T_m}{T_0}\right)=2S_0+2C\log\left(\displaystyle\frac{T_1+T_2}{2T_0}\right)$
A entropia do novo sistema maior do que a soma das entropias individuais:
$\Delta S=2C\log\left(\displaystyle\frac{T_1+T_2}{2T_0}\right)-C\log\left(\displaystyle\frac{T_1}{T_0}\right)-C\log\left(\displaystyle\frac{T_2}{T_0}\right)$
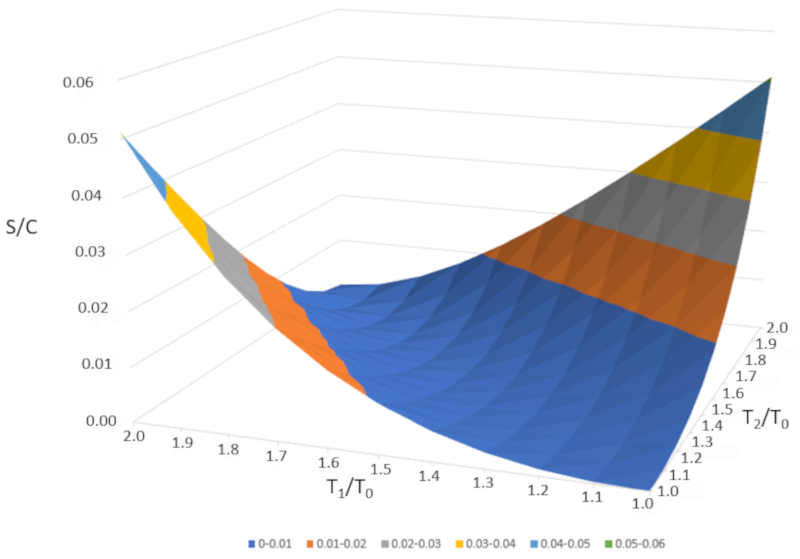
Se representarmos graficamente $\Delta S/C$ em fun o de $T_1/T_0$ e $T_2/T_0," obtemos a seguinte figura:
$\Delta S/C$ quase nulo se as temperaturas forem muito semelhantes ($T_1\sim T_2$). No entanto, se as temperaturas forem diferentes, a entropia sempre aumentar . Se estudarmos isso em outros sistemas, observaremos que sempre que ocorre uma mudan a irrevers vel, a entropia aumenta. A mistura irrevers vel, o que significa que o sistema n o retornar ao seu estado inicial sem interven o externa. Em outras palavras, o sistema n o se separar espontaneamente em dois subsistemas com temperaturas completamente diferentes.
Se ERROR:9498 representa a temperatura de ebuli o, la entropia molar do líquido ($s_L$) corresponde entropia molar do l quido e la entropia molar do sólido ($s_S$) do s lido, ent o a entalpia de vaporiza o ERROR:9497 calculada utilizando a seguinte f rmula:
Se la temperatura de ebulição ($T_b$) a temperatura de ebuli o, la entropia molar do gás (ou vapor) ($s_G$) representa a entropia molar do vapor e la entropia molar do líquido ($s_L$) a do l quido, ent o a entalpia de vaporiza o ERROR:9501 calculada utilizando a seguinte express o:
O valor de la entropia molar ($s$) determinado como uma fun o de la entropia molar de referência ($s_0$), dependendo de o calor específico molar ($c$), ERROR:5199 e la temperatura base ($T_0$), conforme:
O valor de la entropia molar ($s$) determinado como uma fun o de la entropia molar de referência ($s_0$), dependendo de o calor específico molar ($c$), ERROR:5199 e la temperatura base ($T_0$), conforme:
O valor de la entropia molar ($s$) determinado como uma fun o de la entropia molar de referência ($s_0$), dependendo de o calor específico molar ($c$), ERROR:5199 e la temperatura base ($T_0$), conforme:
O valor de la entropia molar ($s$) determinado como uma fun o de la entropia molar de referência ($s_0$), dependendo de o calor específico molar ($c$), ERROR:5199 e la temperatura base ($T_0$), conforme:
O valor de la entropia molar ($s$) determinado como uma fun o de la entropia molar de referência ($s_0$), dependendo de o calor específico molar ($c$), ERROR:5199 e la temperatura base ($T_0$), conforme:
ID:(1471, 0)