Primera ley de la termodinámica
Storyboard 
La primera ley de la termodinámica establece que la energía se conserva y se compone de dos partes: una asociada al trabajo y otra al calor. A diferencia del trabajo, esta última parte no puede transformarse completamente en trabajo, lo que limita las conversiones energéticas posibles.
ID:(1398, 0)
Primera ley de la termodinámica
Storyboard 
La primera ley de la termodinámica establece que la energía se conserva y se compone de dos partes: una asociada al trabajo y otra al calor. A diferencia del trabajo, esta última parte no puede transformarse completamente en trabajo, lo que limita las conversiones energéticas posibles.
Variables
Cálculos
Cálculos
Ecuaciones
Dado que la fuerza mecánica ($F$) dividida por la sección ($S$) es igual a la presión ($p$):
y la variación del volumen ($\Delta V$) con el camino recorrido ($dx$) es igual a:
La ecuaci n para el diferencial inexacto del trabajo ($\delta W$) se puede expresar como:
As que puede ser escrita como:
Dado que el diferencial de la energía interna ($dU$) se relaciona con el diferencial inexacto del calor ($\delta Q$) y el diferencial inexacto del trabajo ($\delta W$) como se muestra a continuaci n:
Y sabiendo que el diferencial inexacto del trabajo ($\delta W$) est relacionado con la presión ($p$) y la variación del volumen ($\Delta V$) de la siguiente manera:
Entonces podemos concluir que:
Ejemplos
La primera ley de la termodin mica, o ley de conservaci n de la energ a, establece que la energ a no puede ser creada ni destruida en un sistema aislado; solo puede ser transferida o transformada. Este principio afirma que la energ a total de un sistema aislado permanece constante. En t rminos pr cticos, esto significa que el cambio en la energ a interna de un sistema es igual al calor a adido al sistema menos el trabajo realizado por el sistema. La energ a interna abarca la energ a total dentro de un sistema, incluyendo la energ a cin tica y potencial a nivel molecular. El calor es la energ a transferida entre sistemas debido a una diferencia de temperatura, mientras que el trabajo es la energ a transferida cuando una fuerza se aplica sobre una distancia, a menudo relacionada con cambios de volumen en los gases. La primera ley es fundamental para analizar la eficiencia de los motores t rmicos, el rendimiento de los sistemas de refrigeraci n y calefacci n, y para entender los procesos metab licos en los sistemas biol gicos. Proporciona una base para comprender las transferencias y transformaciones de energ a en diversos procesos f sicos, asegurando que la energ a dentro de un sistema aislado siempre se conserve.
La primera ley de la termodin mica establece que la energ a siempre se conserva.
Mientras que en la mec nica se enuncia una conservaci n similar restringida a sistemas no disipativos (por ejemplo, excluyendo el rozamiento), en la termodin mica se generaliza considerando no solo el trabajo mec nico, sino tambi n el calor generado o absorbido por el sistema.
En este sentido, la conservaci n de la energ a postulada en la termodin mica no tiene restricciones y es aplicable a todos los sistemas, siempre y cuando se consideren todos los intercambios y conversiones de energ a posibles.
La primera ley de la termodin mica se desarrolla a partir de varios trabajos [1,2], estableciendo que la energ a se conserva, es decir, que el diferencial de la energía interna ($dU$) siempre es igual a el diferencial inexacto del calor ($\delta Q$) suministrado al sistema (positivo) menos el diferencial inexacto del trabajo ($\delta W$) realizado por el sistema (negativo).
Por lo tanto, tenemos:
Mientras que el diferencial exacto no depende de c mo se ejecuta la variaci n, el diferencial inexacto s lo hace. Cuando nos referimos a un diferencial sin especificar que es inexacto, se asume que es exacto.
![]() [1] " ber die quantitative und qualitative Bestimmung der Kr fte" (Sobre la determinaci n cualitativa y cuantitativa de la Fuerza), Julius Robert von Mayer, Annalen der Chemie und Pharmacie, 1842
[1] " ber die quantitative und qualitative Bestimmung der Kr fte" (Sobre la determinaci n cualitativa y cuantitativa de la Fuerza), Julius Robert von Mayer, Annalen der Chemie und Pharmacie, 1842
![]() [2] " ber die Erhaltung der Kraft" (Sobre la conservaci n de la Fuerza), Hermann von Helmholtz, 1847
[2] " ber die Erhaltung der Kraft" (Sobre la conservaci n de la Fuerza), Hermann von Helmholtz, 1847
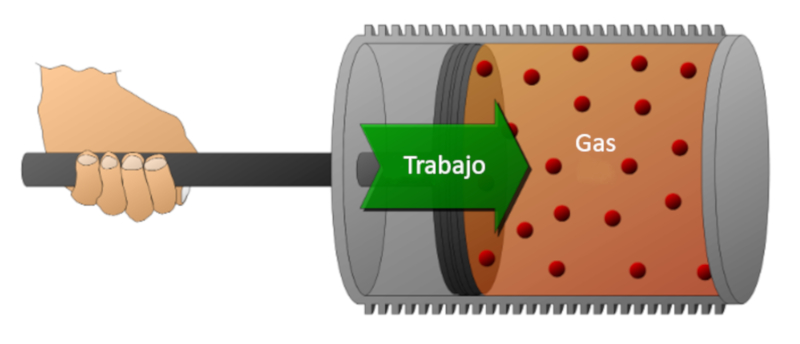
Consideremos un gas en un cilindro en el cual se puede desplazar un pist n. Si se desplaza el pist n, es posible reducir el volumen comprimiendo el gas. Para realizar esta compresi n se requiere de energ a, la cual es igual a la fuerza ejercida por el gas multiplicada por la distancia que recorre el pist n. Esta energ a tambi n puede representarse en funci n de la presi n, ya que sta se define por la fuerza y la superficie del pist n.
El trabajo puede realizarse sobre el sistema (compresi n) o por el sistema sobre el medio externo (expansi n).
Dado que la fuerza mecánica ($F$) dividida por la sección ($S$) es igual a la presión ($p$):
y la variación del volumen ($\Delta V$) con el camino recorrido ($dx$) es igual a:
La ecuaci n para el diferencial inexacto del trabajo ($\delta W$) se puede expresar como:
As que puede ser escrita como:
Dado que el diferencial de la energía interna ($dU$) se relaciona con el diferencial inexacto del calor ($\delta Q$) y el diferencial inexacto del trabajo ($\delta W$) como se muestra a continuaci n:
Y sabiendo que el diferencial inexacto del trabajo ($\delta W$) est relacionado con la presión ($p$) y la variación del volumen ($\Delta V$) de la siguiente manera:
Entonces podemos concluir que:
El diferencial de la energía interna ($dU$) siempre es igual a la cantidad de el diferencial inexacto del calor ($\delta Q$) suministrada al sistema (positiva) menos la cantidad de el diferencial inexacto del trabajo ($\delta W$) realizada por el sistema (negativa):
La variación del trabajo ($\Delta W$) se define como el producto de la fuerza con masa constante ($F$) y la distancia recorrida en un tiempo ($\Delta s$):
La presión de la columna de agua ($p$) se calcula a partir de la fuerza de la columna ($F$) y la sección de la columna ($S$) de la siguiente manera:
Si tenemos un tubo con una la sección del tubo ($S$) que se desplaza una distancia el elemento del tubo ($\Delta s$) a lo largo de su eje, habiendo trasladado el elemento de volumen ($\Delta V$), igual a:
El diferencial inexacto del trabajo ($\delta W$) es igual a la presión ($p$) multiplicado por la variación del volumen ($\Delta V$):
Con la primera ley de la termodin mica, se puede expresar en t rminos de el diferencial de la energía interna ($dU$), el diferencial inexacto del calor ($\delta Q$), la presión ($p$) y la variación del volumen ($\Delta V$) como:
ID:(1398, 0)