Lei Geral dos Gases Ideais
Storyboard 
As três leis dos gases (Lei de Boyle-Mariotte, Lei de Charles, Lei de Gay-Lussac) e o princípio de Avogadro podem ser combinados em uma única lei chamada de lei dos gases ideais.
Isso permite prever a variação de um dos parâmetros que definem o estado do gás (la pressão ($p$), o volume ($V$), la temperatura absoluta ($T$) e o número de moles ($n$)) para um gás ideal, com base no estado inicial e em qualquer estado final definido pelas três variáveis restantes.
ID:(1476, 0)
Lei Geral dos Gases Ideais
Storyboard 
As três leis dos gases (Lei de Boyle-Mariotte, Lei de Charles, Lei de Gay-Lussac) e o princípio de Avogadro podem ser combinados em uma única lei chamada de lei dos gases ideais. Isso permite prever a variação de um dos parâmetros que definem o estado do gás (5224, 5226, 5177 e 9339) para um gás ideal, com base no estado inicial e em qualquer estado final definido pelas três variáveis restantes.
Variáveis
Cálculos
Cálculos
Equações
La pressão ($p$), o volume ($V$), la temperatura absoluta ($T$) e o número de moles ($n$) est o relacionados atrav s das seguintes leis f sicas:
• Lei de Boyle
• Lei de Charles
• Lei de Gay-Lussac
• Lei de Avogadro
Essas leis podem ser expressas de forma mais geral como:
$\displaystyle\frac{pV}{nT}=cte$
Essa rela o geral estabelece que o produto da press o e do volume dividido pelo n mero de moles e a temperatura permanece constante:
La pressão ($p$), o volume ($V$), la temperatura absoluta ($T$) e o número de moles ($n$) est o relacionados atrav s das seguintes leis f sicas:
• Lei de Boyle
• Lei de Charles
• Lei de Gay-Lussac
• Lei de Avogadro
Essas leis podem ser expressas de forma mais geral como:
$\displaystyle\frac{pV}{nT}=cte$
Essa rela o geral estabelece que o produto da press o e do volume dividido pelo n mero de moles e a temperatura permanece constante:
Quando la pressão ($p$) se comporta como um g s ideal, cumprindo com o volume ($V$), o número de moles ($n$), la temperatura absoluta ($T$) e la constante de gás universal ($R_C$), a equa o dos gases ideais:
e a defini o de la concentração molar ($c_m$):
levam seguinte rela o:
Quando la pressão ($p$) se comporta como um g s ideal, cumprindo com o volume ($V$), o número de moles ($n$), la temperatura absoluta ($T$) e la constante de gás universal ($R_C$), a equa o dos gases ideais:
e a defini o de la concentração molar ($c_m$):
levam seguinte rela o:
La pressão ($p$) est associado a o volume ($V$), ERROR:6679, la temperatura absoluta ($T$) e la constante de gás universal ($R_C$) atrav s da equa o:
Uma vez que ERROR:6679 pode ser calculado com la massa ($M$) e la massa molar ($M_m$) usando:
e obtido com a defini o de la constante específica de gás ($R_s$) usando:
conclu mos que:
La pressão ($p$) est associado a o volume ($V$), ERROR:6679, la temperatura absoluta ($T$) e la constante de gás universal ($R_C$) atrav s da equa o:
Uma vez que ERROR:6679 pode ser calculado com la massa ($M$) e la massa molar ($M_m$) usando:
e obtido com a defini o de la constante específica de gás ($R_s$) usando:
conclu mos que:
Se introduzirmos a equa o dos gases escrita com la pressão ($p$), o volume ($V$), la massa ($M$), la constante específica de gás ($R_s$) e la temperatura absoluta ($T$) como:
e usarmos a defini o de la densidade ($\rho$) dada por:
podemos derivar uma equa o espec fica para os gases da seguinte forma:
Se introduzirmos a equa o dos gases escrita com la pressão ($p$), o volume ($V$), la massa ($M$), la constante específica de gás ($R_s$) e la temperatura absoluta ($T$) como:
e usarmos a defini o de la densidade ($\rho$) dada por:
podemos derivar uma equa o espec fica para os gases da seguinte forma:
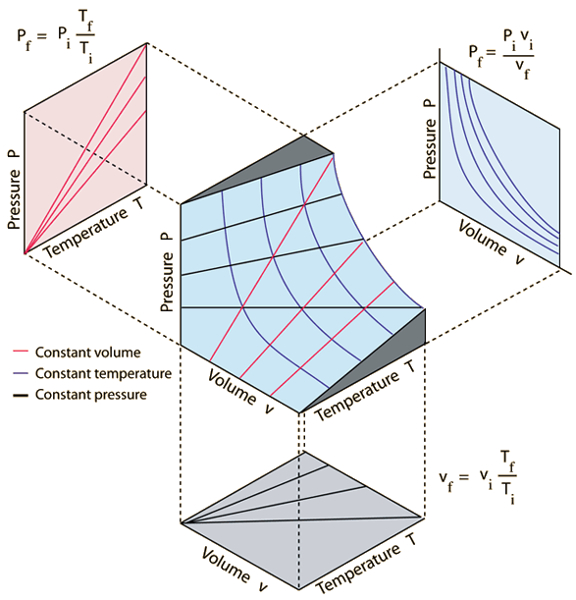
A lei dos gases ideais expressa como
e pode ser escrita como
$\displaystyle\frac{pV}{nT} = R$
Isso implica que as condi es iniciais e finais devem satisfazer a igualdade
$\displaystyle\frac{p_iV_i}{n_iT_i} = R = \displaystyle\frac{p_fV_f}{n_fT_f}$
Assim, obtemos a seguinte equa o:
Exemplos
A lei universal dos gases, tamb m conhecida como lei dos gases ideais, descreve a rela o entre a press o, o volume, a temperatura e o n mero de mols de um g s. Ela combina v rias leis dos gases, incluindo a lei de Boyle, a lei de Charles e o princ pio de Avogadro, em uma nica equa o. Esta lei estabelece que o produto da press o e do volume de um g s diretamente proporcional ao produto da sua temperatura e do n mero de mols de g s. A lei dos gases ideais assume que os gases s o compostos por um grande n mero de mol culas em movimento constante e aleat rio e que as intera es entre essas mol culas s o desprez veis. Esta lei fundamental para prever o comportamento dos gases em diversas condi es e amplamente utilizada tanto na pesquisa cient fica quanto em aplica es pr ticas, como engenharia e qu mica.
O estado de um sistema descrito pela chamada equa o de estado, que estabelece a rela o entre os par metros que caracterizam esse sistema.
No caso dos gases, os par metros que descrevem seu estado s o la pressão ($p$), o volume ($V$), la temperatura absoluta ($T$) e o número de moles ($n$). Geralmente, o ltimo par metro permanece constante, pois est associado quantidade de g s presente.
A equa o de estado, portanto, relaciona press o, volume e temperatura e estabelece que existem apenas dois graus de liberdade, j que a equa o de estado permite o c lculo do terceiro par metro. Em particular, se o volume for fixado, poss vel escolher, por exemplo, a temperatura como vari vel, o que permite calcular a press o correspondente.
As tr s leis dos gases que se relacionam com la pressão ($p$), o volume ($V$) e la temperatura absoluta ($T$) s o:
• A Lei de Boyle, que estabelece que, temperatura constante, o produto da press o e do volume de um g s constante:
• A Lei de Charles, que estabelece que, press o constante, o volume de um g s diretamente proporcional sua temperatura absoluta:
• A Lei de Gay-Lussac, que estabelece que, volume constante, a press o de um g s diretamente proporcional sua temperatura absoluta:
Essas leis podem ser representadas graficamente, como mostrado na seguinte imagem:
Em 1834, mile Clapeyron [1] reconheceu que la pressão ($p$), o volume ($V$), la temperatura absoluta ($T$) e o número de moles ($n$) est o relacionados pela lei de Boyle, pela lei de Charles, pela lei de Gay-Lussac e pela lei de Avogadro. Essas leis podem ser expressas de forma mais geral como:
$\displaystyle\frac{pV}{nT} = \text{constante}$
Essa rela o geral afirma que o produto da press o e do volume, dividido pelo n mero de moles e pela temperatura, permanece constante:
Nessa equa o, la constante de gás universal ($R_C$) assume o valor de 8,314 J/K mol.
[1] "M moire sur la puissance motrice de la chaleur" (Mem ria sobre o poder motriz do calor), mile Clapeyron, Journal de l' cole Polytechnique, 1834.
A lei dos gases ideais expressa como
e pode ser escrita como
$\displaystyle\frac{pV}{nT} = R$
Isso implica que as condi es iniciais e finais devem satisfazer a igualdade
$\displaystyle\frac{p_iV_i}{n_iT_i} = R = \displaystyle\frac{p_fV_f}{n_fT_f}$
Assim, obtemos a seguinte equa o:
Quando la pressão ($p$) se comporta como um g s ideal, cumprindo com o volume ($V$), o número de moles ($n$), la temperatura absoluta ($T$) e la constante de gás universal ($R_C$), a equa o dos gases ideais:
e a defini o de la concentração molar ($c_m$):
levam seguinte rela o:
La pressão ($p$) est associado a o volume ($V$), ERROR:6679, la temperatura absoluta ($T$) e la constante de gás universal ($R_C$) atrav s da equa o:
Uma vez que ERROR:6679 pode ser calculado com la massa ($M$) e la massa molar ($M_m$) usando:
e obtido com a defini o de la constante específica de gás ($R_s$) usando:
conclu mos que:
Se introduzirmos a equa o dos gases escrita com la pressão ($p$), o volume ($V$), la massa ($M$), la constante específica de gás ($R_s$) e la temperatura absoluta ($T$) como:
e usarmos a defini o de la densidade ($\rho$) dada por:
podemos derivar uma equa o espec fica para os gases da seguinte forma:
La pressão ($p$), o volume ($V$), la temperatura absoluta ($T$) e o número de moles ($n$) est o relacionados pela seguinte equa o:
onde la constante de gás universal ($R_C$) tem um valor de 8,314 J/K mol.
La pressão ($p$), o volume ($V$), la temperatura absoluta ($T$) e o número de moles ($n$) est o relacionados pela seguinte equa o:
onde la constante de gás universal ($R_C$) tem um valor de 8,314 J/K mol.
Para um estado inicial (la pressão no estado inicial ($p_i$), o volume no estado i ($V_i$), la temperatura no estado inicial ($T_i$) e o número de moles no estado i ($n_i$)) e um estado final (la pressão em estado final ($p_f$), o volume no estado f ($V_f$), la temperatura no estado final ($T_f$) e o número de moles no estado f ($n_f$)), vale que:
La pressão ($p$) pode ser calculado a partir de la concentração molar ($c_m$) utilizando la temperatura absoluta ($T$) e la constante de gás universal ($R_C$) da seguinte maneira:
La pressão ($p$) pode ser calculado a partir de la concentração molar ($c_m$) utilizando la temperatura absoluta ($T$) e la constante de gás universal ($R_C$) da seguinte maneira:
La pressão ($p$) est relacionado com la massa ($M$) por meio de o volume ($V$), la constante específica de gás ($R_s$) e la temperatura absoluta ($T$) atrav s de:
La pressão ($p$) est relacionado com la massa ($M$) por meio de o volume ($V$), la constante específica de gás ($R_s$) e la temperatura absoluta ($T$) atrav s de:
Ao trabalhar com os dados espec ficos de um g s, la constante específica de gás ($R_s$) pode ser definido em termos de la constante de gás universal ($R_C$) e la massa molar ($M_m$) da seguinte maneira:
Se trabalharmos com a massa ou la densidade ($\rho$) do g s, podemos estabelecer uma equa o an loga dos gases ideais para la pressão ($p$) e la temperatura absoluta ($T$), com a nica diferen a de que a constante ser espec fica para cada tipo de g s e ser denotada como la constante específica de gás ($R_s$):
Se trabalharmos com a massa ou la densidade ($\rho$) do g s, podemos estabelecer uma equa o an loga dos gases ideais para la pressão ($p$) e la temperatura absoluta ($T$), com a nica diferen a de que a constante ser espec fica para cada tipo de g s e ser denotada como la constante específica de gás ($R_s$):
ID:(1476, 0)