Lei de Boyle-Mariotte
Storyboard 
A lei de Boyle-Mariotte estabelece que o produto de la pressão ($p$) e o volume ($V$) de um gás se mantém constante quando a temperatura absoluta e a quantidade de matéria não variam.
Isso significa que la pressão ($p$) varia inversamente proporcional a o volume ($V$).
ID:(1472, 0)
Lei de Boyle-Mariotte
Storyboard 
A lei de Boyle-Mariotte estabelece que o produto de 5224 e 5226 de um gás se mantém constante quando a temperatura absoluta e a quantidade de matéria não variam. Isso significa que 5224 varia inversamente proporcional a 5226.
Variáveis
Cálculos
Cálculos
Equações
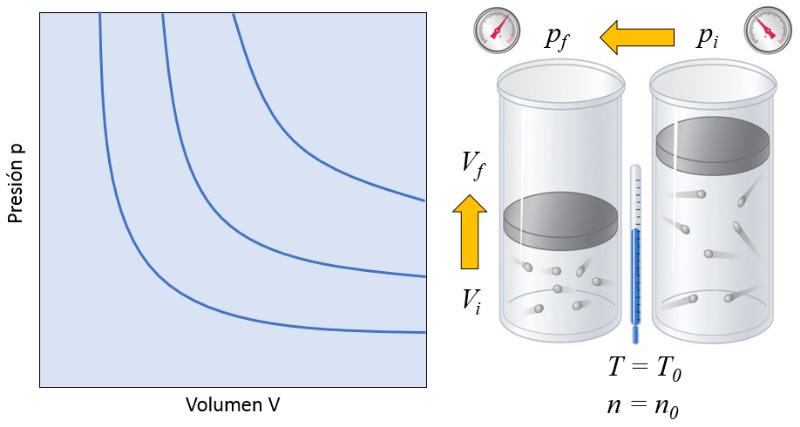
A lei de Boyle estabelece que, com la temperatura absoluta ($T$) constante, o produto de la pressão ($p$) e o volume ($V$) igual a la constante da lei de Boyle ($C_b$):
Isso significa que, se um g s passar de um estado inicial (la pressão no estado inicial ($p_i$) e o volume no estado i ($V_i$)) para um estado final (la pressão em estado final ($p_f$) e o volume no estado f ($V_f$)), mantendo la temperatura absoluta ($T$) constante, ele deve sempre cumprir a lei de Boyle:
$p_i V_i = C_b = p_f V_f$
Portanto, tem-se que:
Se, em uma mudan a isot rmica em que o conte do n o varia, la pressão no estado inicial ($p_i$), la pressão em estado final ($p_f$), o volume no estado i ($V_i$) e o volume no estado f ($V_f$) est o relacionados por:
Ent o, podemos introduzir la densidade ($\rho$), que, junto com la massa ($M$) e o volume ($V$), satisfaz:
O que nos leva a la densidade no estado i ($\rho_i$) e la densidade no estado f ($\rho_f$) como:
Exemplos
A lei de Boyle-Mariotte, tamb m conhecida simplesmente como lei de Boyle, descreve a rela o inversa entre a press o e o volume de um g s a temperatura constante. Ela afirma que, para uma quantidade fixa de g s, quando a temperatura mantida constante, a press o do g s aumenta medida que o volume diminui, e vice-versa. Isso significa que, se voc comprimir um g s reduzindo seu volume, a press o aumentar proporcionalmente, e se voc expandir o volume, a press o diminuir proporcionalmente. Essa rela o fundamental para entender o comportamento dos gases e expressa matematicamente pelo produto da press o e do volume sendo uma constante para uma quantidade de g s dada a temperatura constante.
La pressão ($p$) gerada quando as part culas de g s colidem com a superf cie do recipiente de g s. Como la temperatura absoluta ($T$) constante, a energia das part culas n o varia e os impactos delas com as superf cies do recipiente de g s n o variar o no impulso transferido. No entanto, o n mero de impactos depende do n mero de part culas pr ximas superf cie, que por sua vez proporcional ao la concentração de partículas ($c_n$) do g s.
Por outro lado, a densidade inversamente proporcional a o volume ($V$), resultando na seguinte rela o:
$p \propto c_n \propto \displaystyle\frac{1}{V}$
Em um g s, se tanto la temperatura absoluta ($T$) quanto o número de partículas ($N$) forem mantidos constantes, observa-se que o volume ($V$) e la pressão ($p$) variam de forma inversamente proporcional. Sempre que o volume ($V$) reduzido, la pressão ($p$) aumenta, e vice-versa,
$p \propto \displaystyle\frac{1}{V}$
como ilustrado no gr fico a seguir:
A rela o entre o número de partículas ($N$) e la temperatura absoluta ($T$) que seu produto igual a uma constante da lei de Boyle ($C_b$), o que corresponde lei de Boyle [1], em homenagem ao seu descobridor Robert Boyle:
s vezes falamos da lei Boyle-Mariotte, lembrando o f sico franc s Edme Mariotte que descobriu a mesma lei de forma independente em 1676.
![]() [1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Novos experimentos f sico-mec nicos, tocando a mola do ar e seus efeitos), Robert Boyle, Oxford: impresso por H. Hall, Printer to the University, para Tho. Robinson (1660).
[1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Novos experimentos f sico-mec nicos, tocando a mola do ar e seus efeitos), Robert Boyle, Oxford: impresso por H. Hall, Printer to the University, para Tho. Robinson (1660).
Robert Boyle foi um cientista irland s nascido em 1627. Ele considerado um dos fundadores da qu mica moderna e conhecido por suas contribui es no campo do comportamento dos gases. A rela o entre Robert Boyle e a Lei de Boyle se deve ao fato de que ele formulou essa lei no s culo XVII. A Lei de Boyle estabelece que, temperatura constante, o volume de um g s inversamente proporcional sua press o. Boyle realizou experimentos que comprovaram essa rela o e lan aram as bases para a compreens o do comportamento dos gases.
A lei de Boyle estabelece que, com la temperatura absoluta ($T$) constante, o produto de la pressão ($p$) e o volume ($V$) igual a la constante da lei de Boyle ($C_b$):
Isso significa que, se um g s passar de um estado inicial (la pressão no estado inicial ($p_i$) e o volume no estado i ($V_i$)) para um estado final (la pressão em estado final ($p_f$) e o volume no estado f ($V_f$)), mantendo la temperatura absoluta ($T$) constante, ele deve sempre cumprir a lei de Boyle:
$p_i V_i = C_b = p_f V_f$
Portanto, tem-se que:
Se, em uma mudan a isot rmica em que o conte do n o varia, la pressão no estado inicial ($p_i$), la pressão em estado final ($p_f$), o volume no estado i ($V_i$) e o volume no estado f ($V_f$) est o relacionados por:
Ent o, podemos introduzir la densidade ($\rho$), que, junto com la massa ($M$) e o volume ($V$), satisfaz:
O que nos leva a la densidade no estado i ($\rho_i$) e la densidade no estado f ($\rho_f$) como:
A lei de Boyle estabelece uma rela o entre o volume ($V$) e la pressão ($p$), afirmando que seu produto igual a la constante da lei de Boyle ($C_b$), da seguinte maneira:
A lei de Boyle estabelece uma rela o entre o volume ($V$) e la pressão ($p$), afirmando que seu produto igual a la constante da lei de Boyle ($C_b$), da seguinte maneira:
Se um g s passa de um estado inicial (i) para um estado final (f) com la temperatura absoluta ($T$) constante, a seguinte rela o v lida para la pressão no estado inicial ($p_i$), la pressão em estado final ($p_f$), o volume no estado i ($V_i$) e o volume no estado f ($V_f$):
A lei de Boyle para o estado inicial (la densidade no estado i ($\rho_i$), la pressão no estado inicial ($p_i$)) e o estado final (la densidade no estado f ($\rho_f$), la pressão em estado final ($p_f$)) dada por:
ID:(1472, 0)