Énergie interne
Storyboard 
L'énergie interne d'un système se compose d'énergie cinétique et d'énergie potentielle. L'énergie cinétique est associée à la chaleur et peut être liée aux oscillations des atomes autour de leurs points d'équilibre. D'autre part, l'énergie potentielle est associée au travail que le système est capable de réaliser.
ID:(1469, 0)
Mécanismes
Définition 
L'énergie interne est l'énergie totale contenue dans un système thermodynamique en raison des énergies cinétique et potentielle de ses molécules. Elle comprend l'énergie provenant du mouvement moléculaire (translationnel, rotationnel et vibrationnel) ainsi que l'énergie des interactions intermoléculaires et des liaisons chimiques. L'énergie interne est une fonction d'état, ce qui signifie qu'elle dépend uniquement de l'état actuel du système et non de la manière dont le système a atteint cet état. Les changements d'énergie interne se produisent lorsque de la chaleur est ajoutée ou retirée du système ou lorsque du travail est effectué sur ou par le système. Ce concept est fondamental en thermodynamique, décrivant les changements d'énergie dans des processus tels que les processus isothermes, adiabatiques, isobares et isochores. L'énergie interne aide à déterminer les états d'équilibre et la stabilité du système, car les systèmes tendent à évoluer vers des états avec une énergie interne plus faible. Elle fournit une mesure complète de toutes les formes d'énergie microscopique à l'intérieur d'un système, essentielle pour comprendre les transformations d'énergie dans divers processus.
ID:(15245, 0)
Énergie cinétique
Image 
Énergie cinétique de translation : Cette énergie est associée au mouvement linéaire des particules dans le système. Plus la vitesse de translation des particules est élevée, plus leur énergie cinétique de translation est grande.
Énergie cinétique de rotation : Certaines particules, comme les atomes ou les molécules, peuvent tourner autour d'un axe. Cette rotation est associée à l'énergie cinétique de rotation, qui dépend de la masse et de la vitesse angulaire des particules.
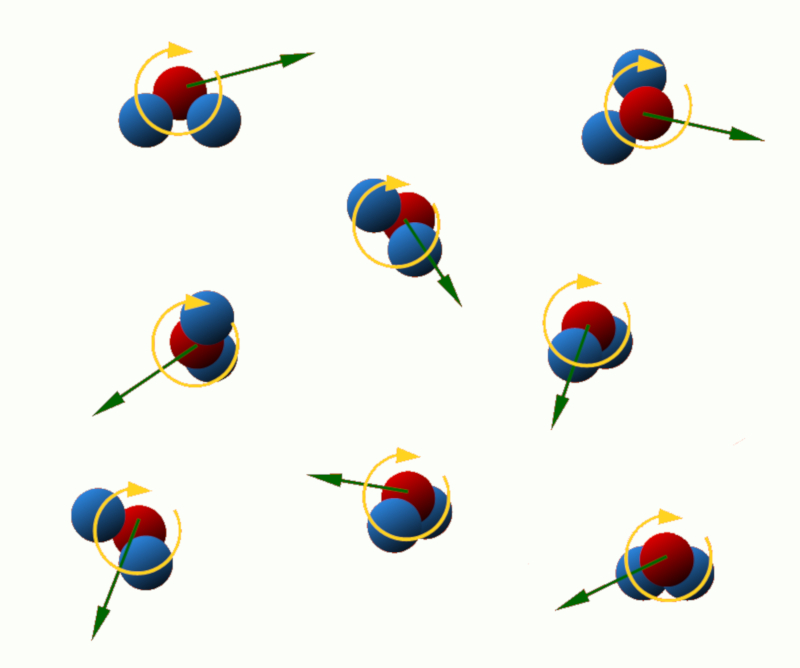
ID:(11122, 0)
Énergie de liaison
Noter 
Énergie potentielle de liaison : Cette énergie est liée aux forces d'interaction entre les particules du système. Par exemple, dans un solide, l'énergie de liaison est due aux forces attractives entre les atomes ou les molécules voisins.
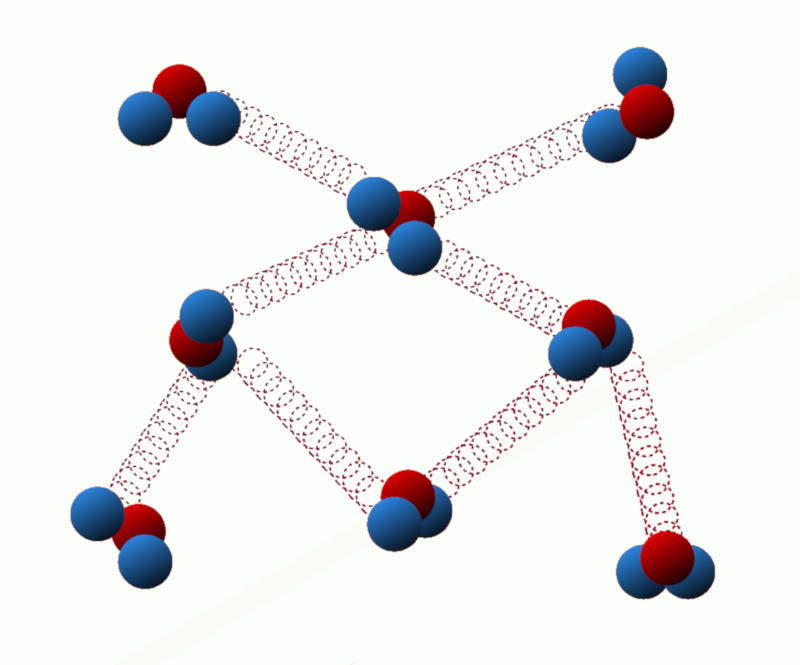
ID:(11123, 0)
Énergie chimique
Citation 
Énergie d'excitation : Certains systèmes peuvent subir des changements dans leur état énergétique, par exemple lorsque les électrons dans un atome ou une molécule sont excités. L'énergie associée à ces états excités est appelée énergie d\'excitation.
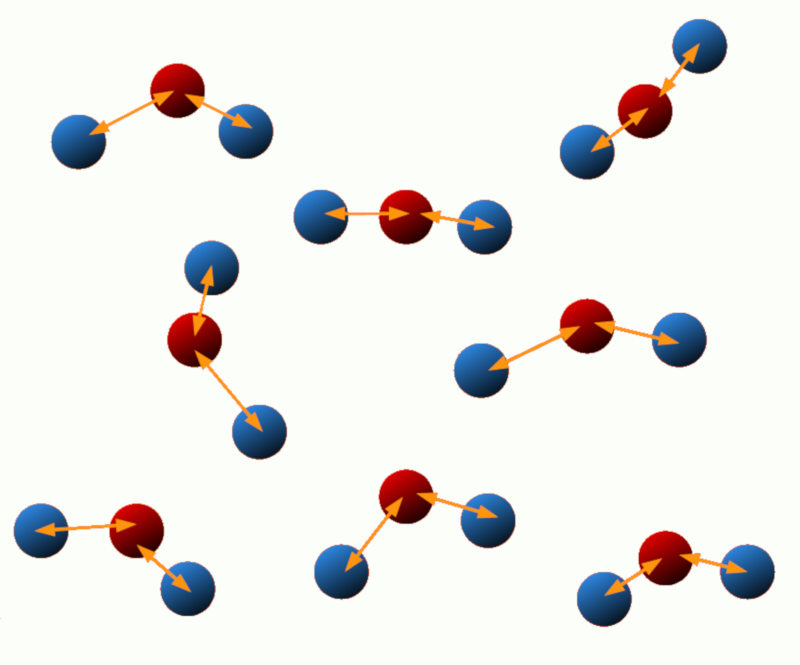
ID:(11124, 0)
Énergie d'excitation
Exercer 
Énergie chimique (énergie électrique) : Dans les systèmes chimiques, des réactions chimiques peuvent libérer ou absorber de l'énergie. Cette énergie est appelée énergie chimique et est liée aux liaisons chimiques présentes dans les molécules.
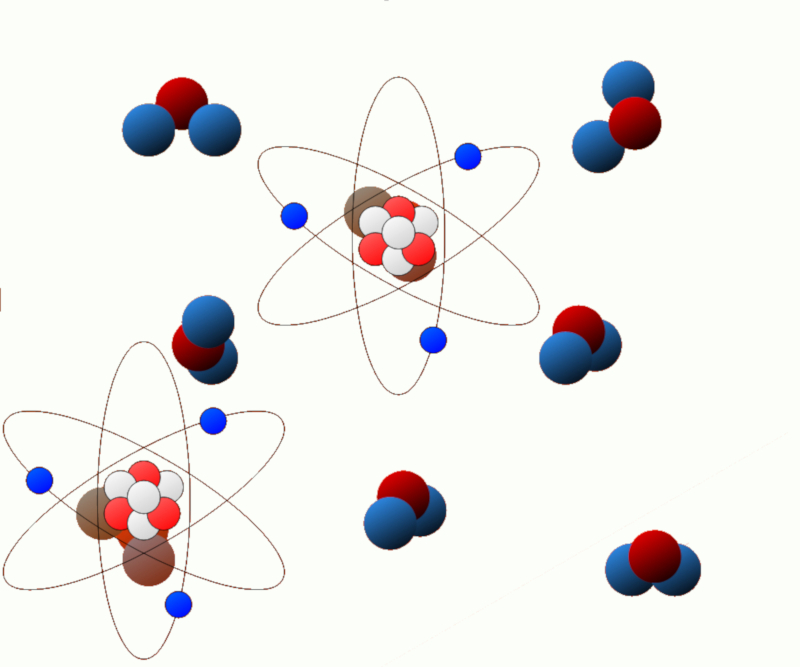
ID:(11125, 0)
Énergie interne
Équation 
L'énergie interne est l'énergie totale possédée par les particules qui composent un système. Ces énergies comprennent :
• Énergie cinétique de translation : Cette énergie est associée au mouvement linéaire des particules dans le système. Plus la vitesse de translation des particules est élevée, plus leur énergie cinétique de translation est grande.
• Énergie cinétique de rotation : Certaines particules, comme les atomes ou les molécules, peuvent tourner autour d'un axe. Cette rotation est associée à l\'énergie cinétique de rotation, qui dépend de la masse et de la vitesse angulaire des particules.
• Énergie potentielle de liaison : Cette énergie est liée aux forces d\'interaction entre les particules du système. Par exemple, dans un solide, l\'énergie de liaison est due aux forces attractives entre les atomes ou les molécules voisins.
• Énergie chimique (énergie électrique) : Dans les systèmes chimiques, des réactions chimiques peuvent libérer ou absorber de l\'énergie. Cette énergie est appelée énergie chimique et est liée aux liaisons chimiques présentes dans les molécules.
• Énergie d\'excitation : Certains systèmes peuvent subir des changements dans leur état énergétique, par exemple lorsque les électrons dans un atome ou une molécule sont excités. L\'énergie associée à ces états excités est appelée énergie d\'excitation.
ID:(11121, 0)
