Convección
Storyboard 
La diferencia de presión atmosférica lleva a desplazamiento de masas de aire tanto a nivel de superficie como en las alturas.
El flujo vertical se denomina convección y es clave para la formación de nubes, generación de lluvias y flujo efectivo de energía entre superficie y atmósfera.
ID:(552, 0)
Convección
Definición 
Al calentarse una masa de aire esta tiende a dilatarse reduciendose su densidad.
La expansión en si crea una situación en que la presión en su parte superior es menor que en su parte inferior lo que da origen a una diferencia de presión y con ello a una fuerza.
Esta fuerza es analoga a la fuerza de sustentación en el agua, con la diferencia de que con la altura se va reduciendo hasta el punto que ya no supera la gravedad y el cuerpo no continua acendiendo.
ID:(40, 0)
Energía potencial de convección
Imagen 
El proceso de convección se describe con el diagrama de presión y temperatura en que se diagraman
- la adiabata de aire seco
- la adiabata de aire humedio
- la temperatura ambiental
y se determina como el volumen evolucionara:
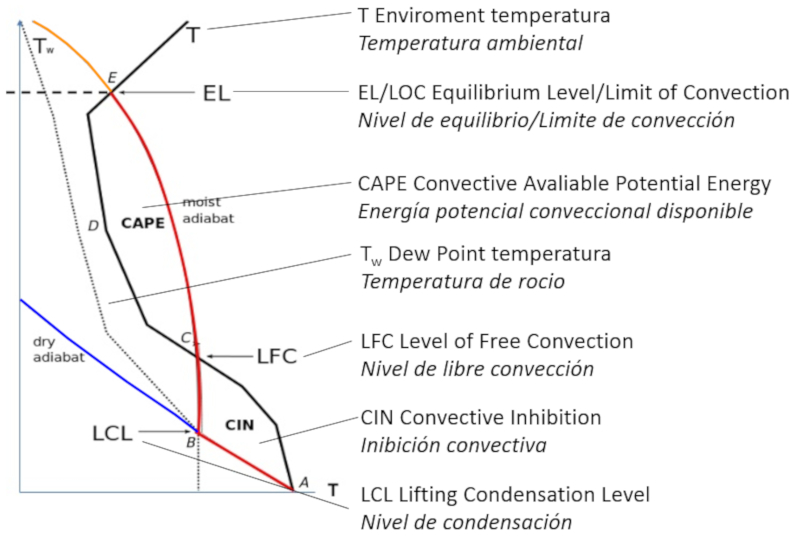
Diagrama de CAPE (Energía potencial de convección disponible)
En el diagrama se muestra como la masa de aire sube:
- sin condesar desde A a B donde inicia la condensación
- comienza a condesar y sube de B a C contra la resistencia CIN
- continua subiendo de C a D impulsado por la energía potencial de condensación
La fase CIN puede evitar que la masa sufra la convección y vuelva a decender.
ID:(3098, 0)
Convección
Descripción 
La diferencia de presión atmosférica lleva a desplazamiento de masas de aire tanto a nivel de superficie como en las alturas. El flujo vertical se denomina convección y es clave para la formación de nubes, generación de lluvias y flujo efectivo de energía entre superficie y atmósfera.
Variables
Cálculos
Cálculos
Ecuaciones
(ID 8836)
Ejemplos
Al calentarse una masa de aire esta tiende a dilatarse reduciendose su densidad.
La expansi n en si crea una situaci n en que la presi n en su parte superior es menor que en su parte inferior lo que da origen a una diferencia de presi n y con ello a una fuerza.
Esta fuerza es analoga a la fuerza de sustentaci n en el agua, con la diferencia de que con la altura se va reduciendo hasta el punto que ya no supera la gravedad y el cuerpo no continua acendiendo.
(ID 40)
El inicio de convecci n t rmica esta descrito por el n mero de Rayleigh que incluye una serie de par metros propios del aire y otros geom tricos de la situaci n
| $Ra=\displaystyle\frac{\rho^2 g c_p}{\eta\lambda}\displaystyle\frac{(T_e-T_t)}{T_e}h^3$ |
y que permite determinar cuando la situaci n se vuelve inestable.
Para un sistema entre dos placas con las temperaturas inferior
En el caso de corrientes a reas la densidad es
por lo que con el gradiente
se concluye que pr cticamente siempre de tiene las condiciones para que exista convecci n.
(ID 9040)
En general el flujo del aire se puede modelar mediante la ecuaci n de Navier Stokes
| $\rho v\displaystyle\frac{dv}{dx}=(\rho_m-\rho) g$ |
que en el caso de un flujo unidimensional en una dimensi n se puede escribir como
| $\rho v\displaystyle\frac{dv}{dx}=(\rho_m-\rho) g$ |
donde
Si la velocidad inicial es cero la integraci n de la ecuaci n nos dar
| $v(z)^2=2g\displaystyle\int_0^zds\displaystyle\frac{(\rho_m(s)-\rho(s))}{\rho(s)}$ |
(ID 9938)
El flujo de un liquido o gas es descritos mediante la ecuaci n de Navier Stokes
| $ \rho \left(\displaystyle\frac{\partial\vec{u}}{\partial t}+\vec{u}\cdot\nabla\vec{u}\right)=-\nabla p+\eta\nabla^2\vec{u}+\displaystyle\frac{1}{3}\nabla(\nabla\cdot\vec{u})+\rho\vec{g}$ |
que en la aproximaci n de baja viscosidad, una situaci n que se puede modelar dimensional y es un flujo estacionario se reduce a
El gradiente de la presi n se modela en este caso con la presi n barom trica dando
| $\rho v\displaystyle\frac{dv}{dx}=(\rho_m-\rho) g$ |
(ID 9937)
Para el caso de que la masa de aire asciende en forma lenta la ecuaci n hidrodin mica de Navier Stokes en una dimensi n se puede escribir como
| $\rho v\displaystyle\frac{dv}{dx}=(\rho_m-\rho) g$ |
donde
Si la velocidad inicial es cero la integraci n de la ecuaci n nos dara
| $ v(z) ^2 = 2 g \displaystyle\int_0^zds\displaystyle\frac{( \rho_m(s) - \rho(s) )}{ \rho(s) }$ |
(ID 4869)
Como la densidad es proporcional al inverso de la temperatura
se tiene que el factor
en
| $ v(z) ^2 = 2 g \displaystyle\int_0^zds\displaystyle\frac{( \rho_m(s) - \rho(s) )}{ \rho(s) }$ |
se puede reemplazar por
e introducir
| $CAPE=g\displaystyle\int_0^z ds\displaystyle\frac{(T(s)-T_m(s))}{T_m(s)}$ |
que tiene unidades de energ a y corresponde a la energ a potencial de convecci n CAPE.
(ID 9923)
Con la velocidad de ascenso dada por
| $ v(z) ^2 = 2 g \displaystyle\int_0^zds\displaystyle\frac{( \rho_m(s) - \rho(s) )}{ \rho(s) }$ |
y la definici n del CAPE
| $CAPE=g\displaystyle\int_0^z ds\displaystyle\frac{(T(s)-T_m(s))}{T_m(s)}$ |
se tiene que la velocidad de ascenso en funci n del CAPE es
| $ v =\sqrt{2 CAPE }$ |
(ID 8836)
El proceso de convecci n se describe con el diagrama de presi n y temperatura en que se diagraman
- la adiabata de aire seco
- la adiabata de aire humedio
- la temperatura ambiental
y se determina como el volumen evolucionara:

Diagrama de CAPE (Energ a potencial de convecci n disponible)
En el diagrama se muestra como la masa de aire sube:
- sin condesar desde A a B donde inicia la condensaci n
- comienza a condesar y sube de B a C contra la resistencia CIN
- continua subiendo de C a D impulsado por la energ a potencial de condensaci n
La fase CIN puede evitar que la masa sufra la convecci n y vuelva a decender.
(ID 3098)
Para un proceso adiab tico el trabajo es
con
que para un gas ideal es 5/3. De la primera ley de la termodin mica se tiene que
Como en el caso de la atm sfera es
se tiene que el gradiente adiab tico es
para el caso del aire seco es
| $\Gamma=\displaystyle\frac{g}{c_p}$ |
que corresponde a 9.8 C/km.
(ID 9924)
La relaci n de masas molares del vapor de agua con el aire se define como la relaci n de las masas molares de cada componente presentes en un volumen:
| $\zeta=\displaystyle\frac{M_{mol,v}}{M_{mol,a}}$ |
Como los valores son fijos se puede estimar el valor, el que resulta ser igual a
(ID 9925)
La relaci n de mezcla del vapor de agua con el aire se define como la relaci n de las masas de cada componente presentes en un volumen:
$\displaystyle\frac{M_v}{M_a}=\displaystyle\frac{n_vM_{mol,v}}{n_aM_{mol,a}}=\displaystyle\frac{p_v}{p_a}\displaystyle\frac{M_{mol,v}}{M_{mol,a}}\sim 0.01$
Donde $M_v$ y $M_a$ son las masas de vapor de agua y aire respectivamente, $n_v$ y $n_a$ son las moles de vapor de agua y aire, $M_{mol,v}$ y $M_{mol,a}$ son las masas molares de vapor de agua y aire, $p_v$ y $p_a$ son las presiones relativas de vapor de agua y aire, y $r$ es la relaci n de mezcla. Por ello se tiene que es
| $ r =\displaystyle\frac{ M_v }{ M_a }$ |
En el caso espec fico del vapor de agua en el aire, la relaci n de mezcla es proporcional a las presiones relativas, que se pueden cuantificar utilizando la presi n de vapor de agua $p_v\sim 1500 Pa$ y la presi n del aire $p_a\sim 10^5 Pa$. Al aplicar la ecuaci n de los gases y la definici n de la masa molar, se obtiene que la relaci n de mezcla es aproximadamente $0.01$. Esto significa que la cantidad de vapor de agua en comparaci n con el aire es baja en condiciones normales.
(ID 7069)
Con la relaci n de mezcla de vapor de agua en funci n de la masa:
| $ r =\displaystyle\frac{ M_v }{ M_a }$ |
la relaci n entre moles y masas
| $ n = \displaystyle\frac{ M }{ M_m }$ |
y la relaci n entre masas molares
| $\zeta=\displaystyle\frac{M_{mol,v}}{M_{mol,a}}$ |
se obtiene la relaci n de mezcla de vapor de agua con aire en funci n de los moles
| $ \displaystyle\frac{ n_v }{ n_a }=\displaystyle\frac{ r }{ \zeta }$ |
(ID 9933)
La variaci n del calor esta para aire seco:
| $ \Delta Q = C_p \Delta T $ |
Para el caso de aire h medo debe considerarse tambi n la masa del vapor de agua. Como la proporci n de masa es
| $ r =\displaystyle\frac{ M_v }{ M_a }$ |
se tiene que la masa se puede escribir como
donde
| $ \delta Q = M_a(1+ r ) c_p dT $ |
(ID 9927)
La variaci n del trabajo esta para aire seco:
| $ \delta W = p dV $ |
Para el caso de aire h medo debe considerarse los moles del vapor de agua. Con la ecuaci n de los gases
| $ p V = n R_C T $ |
se puede definir el numero total de moles en funci n de los moles del aire
con lo que la ecuaci n de estado es
| $ \delta W =-\left(1+\displaystyle\frac{ r }{ \zeta }\right) n_a R_C T \displaystyle\frac{ dV }{ V }$ |
(ID 9928)
En el caso del proceso adiabatico
| $ \delta Q =0$ |
Como el calor es para el caso de aire h medo es:
| $ \delta Q = M_a(1+ r ) c_p dT $ |
y el trabajo
| $ \delta W =-\left(1+\displaystyle\frac{ r }{ \zeta }\right) n_a R_C T \displaystyle\frac{ dV }{ V }$ |
se obtiene con
| $ \kappa \equiv1+\displaystyle\frac{ R_C }{ M_m c_V }$ |
se obtiene la ecuaci n de estado
| $\displaystyle\frac{dT}{T}=-\displaystyle\frac{(1+r/\zeta)}{(1+r)}(\kappa-1)\displaystyle\frac{dV}{V}$ |
Al ser
(ID 9926)
En el caso de que el aire esta saturado, la presi n del vapor de agua es:
| $ p_s = p_{ref} e^{- l_m / R_C T }$ |
y con la ecuaci n de los gases expresada en funci n de la concentraci n
| $ p = c_m R_C T $ |
se obtiene que
Si la temperatura varia en una peque a cantidad
Como el calor latente del agua es del orden de
| $ dc_s = c_s \displaystyle\frac{ l_m }{ R_C T ^2} dT $ |
(ID 9929)
Como la concentraci n varia con la temperatura en primer orden como:
| $ dc_s = c_s \displaystyle\frac{ l_m }{ R_C T ^2} dT $ |
y la concentraci n se define como
| $ c_m \equiv\displaystyle\frac{ n }{ V }$ |
se concluye con
| $ n = \displaystyle\frac{ M }{ M_m }$ |
que la variaci n de la masa es
| $ dM_s = M_s \displaystyle\frac{ l_m }{ R_C T ^2} dT $ |
(ID 9934)
Al estar saturado el ractor de mezcla
| $ r =\displaystyle\frac{ M_v }{ M_a }$ |
se debe calcular con la masa saturada que se puede obtener de la concentraci n saturada multiplicando por el volumen y la masa molar
Como por el otro lado la masa del aire es
se obtiene que la relaci n de mezclado del vapor de agua saturado es
| $ r_s = \zeta_s \displaystyle\frac{ p_0 }{ p_a }e^{- l_m / R_C T }$ |
(ID 9935)
La variaci n del calor esta para aire seco:
| $ \Delta Q = C_p \Delta T $ |
Para el caso de aire saturado debe considerarse que la variaci n del vapor de agua lleva al aumento de la masa saturada la que aumenta seg n
| $ dM_s = M_s \displaystyle\frac{ l_m }{ R_C T ^2} dT $ |
y que entrega el calor que se obtiene multiplicando este valor por el calor latente
Como ademas la masa del vapor de agua se puede relacionar con la masa de aire por la relaci n de mezcla
| $ r =\displaystyle\frac{ M_v }{ M_a }$ |
se concluye que el calor se modifica con la variaci n de la temperatura como
| $ \delta Q = M_a \left( c_p +\displaystyle\frac{ l_m ^2 r_s }{ R_C T ^2}\right) dT $ |
donde la relaci n de mezcla es
| $ r_s = \zeta_s \displaystyle\frac{ p_0 }{ p_a }e^{- l_m / R_C T }$ |
(ID 9931)
La variaci n del trabajo esta para aire seco:
| $ \delta W = p dV $ |
Para el caso de aire saturado debe considerarse que la variaci n del vapor de agua lleva al aumento de la concentraci n saturada la que aumenta seg n
| $ dc_s = c_s \displaystyle\frac{ l_m }{ R_C T ^2} dT $ |
con lo que la ecuaci n de estado es
| $ \delta W =-\left(1+\displaystyle\frac{ l_m r_s }{ R_C T }\right) n_a R_C T \displaystyle\frac{ dV }{ V }$ |
donde la relaci n de mezcla es
| $ r_s = \zeta_s \displaystyle\frac{ p_0 }{ p_a }e^{- l_m / R_C T }$ |
(ID 9930)
En el caso del proceso adiabatico
| $ \delta Q =0$ |
Como el calor es para el caso de aire h medo es:
| $ \delta Q = M_a \left( c_p +\displaystyle\frac{ l_m ^2 r_s }{ R_C T ^2}\right) dT $ |
y el trabajo
| $ \delta W =-\left(1+\displaystyle\frac{ l_m r_s }{ R_C T }\right) n_a R_C T \displaystyle\frac{ dV }{ V }$ |
se obtiene con
| $ \kappa \equiv1+\displaystyle\frac{ R_C }{ M_m c_V }$ |
se obtiene la ecuaci n de estado
| $ \displaystyle\frac{ dT }{ T }=-\displaystyle\frac{\left(1+\displaystyle\frac{ l_m r_s }{ R_C T }\right)}{\left(1+\displaystyle\frac{ l_m ^2 r_s }{ c_p R_C T ^2}\right)}( \kappa -1)\displaystyle\frac{ dV }{ V }$ |
Si se evalua el factor que se antepone a el factor
(ID 9932)
Para el caso del aire no saturado el gradiente adiab tico era
| $\Gamma=\displaystyle\frac{g}{c_p}$ |
que con la ecuaci n del proceso adiabatico saturado
| $ \displaystyle\frac{ dT }{ T }=-\displaystyle\frac{\left(1+\displaystyle\frac{ l_m r_s }{ R_C T }\right)}{\left(1+\displaystyle\frac{ l_m ^2 r_s }{ c_p R_C T ^2}\right)}( \kappa -1)\displaystyle\frac{ dV }{ V }$ |
con lo que el coeficiente adiab tico para aire saturado es
| $ \Gamma =\displaystyle\frac{ g }{ c_p }\displaystyle\frac{1+\displaystyle\frac{ l_m r_s }{ R_C T }}{1+\displaystyle\frac{ l_m ^2 r_s \epsilon}{ c_p R_C T ^2}}$ |
El valor se puede representar como el coeficiente adiab tico no saturado multiplicado por un coeficiente que es del orden de 0.55. De esta forma el coeficiente adiab tico de aire saturado es del orden de 5.4 C/km.
(ID 3097)
ID:(552, 0)
