Solutions Phase Diagram
Definition 
In a phase diagram of a solution, the boundaries between phases shift in such a way that, at the same pressure, the melting point decreases while the boiling point increases:
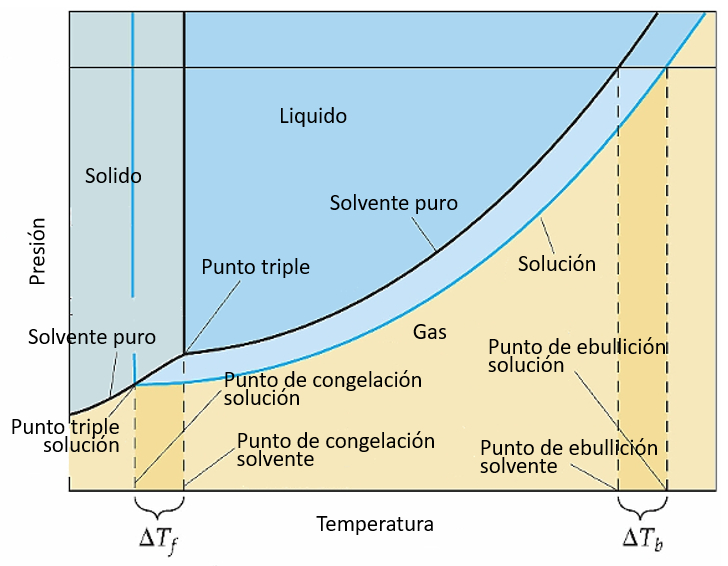
ID:(1980, 0)
