Presión Osmótica
Storyboard 
La presencia de iones en un soluto también afecta la presión que el sistema ejerce llevando a una reducción de esta. El fenómeno se describe con la llamada presión osmótica que se considera como una presión negativa, es decir una presión que reduce la presión del sistema.
ID:(568, 0)
Presión osmótica y tubo U
Definición 
Cuando se coloca una membrana semipermeable en el fondo de un tubo en forma de U y se agrega agua, se puede observar que al agregar material disuelto, la columna con el soluto se eleva:
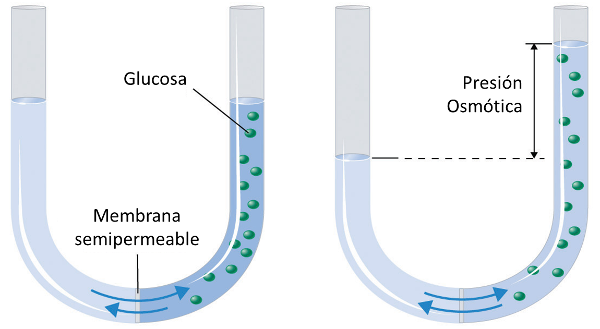
Esto se debe a la presión negativa generada por la presión osmótica.
ID:(2024, 0)
Presión Osmótica
Descripción 
La presencia de iones en un soluto también afecta la presión que el sistema ejerce llevando a una reducción de esta. El fenómeno se describe con la llamada presión osmótica que se considera como una presión negativa, es decir una presión que reduce la presión del sistema.
Variables
Cálculos
Cálculos
Ecuaciones
Ejemplos
Si consideramos una soluci n con una presi n separada del solvente con puro por una membrana semipermeable los potenciales qu micos deben ser iguales. Si suponemos que la temperatura es igual a ambos lados de la membrana se tendr que con
| $ g_0(p,T) = g_0(p',T) -\displaystyle\frac{ N_s }{ N } k_B T $ |
donde
(ID 4064)
Cuando se tiene una membrana que separa solvente puro de solvente con soluto se presentara una presi n negativa que debe ser igual\\n\\n
$\Psi=p-p'$
\\n\\ny que denominaremos presi n osm tica. Para obtener una expresi n para la presi n osm tica basta expandir la funci n molar de Gibbs en $\Psi$:\\n\\n
$g_0(p'+\Psi,T)\sim g_0(p',T)+\left(\displaystyle\frac{\partial g_0}{\partial p}\right)_T\Psi$
lo que en la ecuaci n con constante de Boltzmann $J/K$, energía libre molar de Gibbs solvente con presencia del soluto $J$, energía libre molar de Gibbs solvente sin soluto $J$, numero de partículas de soluto $-$, numero de partículas del solvente $-$ y temperatura $K$
| $ g_0(p,T) = g_0(p',T) -\displaystyle\frac{ N_s }{ N } k_B T $ |
nos deja con constante de Boltzmann $J/K$, energía libre molar de Gibbs solvente con presencia del soluto $J$, energía libre molar de Gibbs solvente sin soluto $J$, numero de partículas de soluto $-$, numero de partículas del solvente $-$ y temperatura $K$
| $ \Psi =-\displaystyle\frac{ N_s }{ N }\displaystyle\frac{ k_B T }{\left(\displaystyle\displaystyle\frac{\partial g_0 }{\partial p }\right)_T}$ |
(ID 4154)
La deriva de la energ a libre de Gibbs respecto de la presi n es igual al volumen\\n\\n
$V=\displaystyle\frac{\partial G}{\partial p}$
por lo que la derivada de la energ a libre de Gibbs por part cula es
| $\displaystyle\frac{\partial g_0 }{\partial p }=\displaystyle\frac{ V }{ N }$ |
(ID 9045)
Con la presi n osm tica es con constante de Boltzmann $J/K$, energía libre molar de Gibbs $J$, numero de partículas de soluto $-$, numero de partículas del solvente $-$, presión $Pa$, presión de las partículas del soluto $Pa$ y temperatura $K$ es igual a
| $ \Psi =-\displaystyle\frac{ N_s }{ N }\displaystyle\frac{ k_B T }{\left(\displaystyle\displaystyle\frac{\partial g_0 }{\partial p }\right)_T}$ |
La deriva de la funci n molar de Gibbs se puede reemplazar por el volumen molar con energía libre molar de Gibbs $J$, presión $Pa$ y volumen molar $m^3/mol$ mediante
| $\displaystyle\frac{\partial g_0 }{\partial p }=\displaystyle\frac{ V }{ N }$ |
\\n\\ncon lo que la presi n osm tica es\\n\\n
$ \Psi =-\displaystyle\frac{ N_s }{ V } k_B T $
Si recordamos que la constante de los gases es con
| $ R_C = N_A k_B $ |
se tiene que con
| $ \Psi =\displaystyle\frac{ n_s }{ V } R T $ |
\\n\\ncon
$n_s=\displaystyle\frac{N_s}{N_A}$
Esta ecuaci n tiene la forma de una ecuaci n de los gases ideales o sea las mol culas de soluto en suspensi n se comportan como un gas ideal.
(ID 4155)
Cuando se coloca una membrana semipermeable en el fondo de un tubo en forma de U y se agrega agua, se puede observar que al agregar material disuelto, la columna con el soluto se eleva:

Esto se debe a la presi n negativa generada por la presi n osm tica.
(ID 2024)
ID:(568, 0)
