Comportamiento en la línea de equilibrio entre fases
Imagen
Si se estudian las fases de un sistema (solido, liquido, gas) bajo distintas presiones y temperaturas se notara que existen zonas claramente delimitadas de estados definidas por lineas en que conviven dos estados. Estas lineas se definen como relaciones entre la presión y temperatura y parecen en primera aproximación ser relaciones lineales:

Existe ademas un punto en que las tres fases existen simultáneamente. Dicho punto se denomina el punto triple. Existe ademas un segundo punto llamado punto critico en que la diferenciación entre gas y liquido se pierde no existiendo una separación definida ni energías que se asocien a convertir una en la otra.
ID:(837, 0)
Cambio de fase
Ecuación
Si se tiene un sistema
Si el sistema consta de
$n=n_1+n_2$
\\n\\nsin embargo, como el sistema se considera cerrado, todo cambio no variara el numero total de moles:\\n\\n
$dn=dn_1+dn_2=0$
\\n\\nSi la energía libre de Gibbs por mol del sistema en la fase 1 es
$G=n_1g_1+n_2g_2$
\\n\\nComo la energía libre por mol depende de la presión, temperatura y tipo de fase se tendrá que una variación será igual a\\n\\n
$dG=g_1dn_1+g_2dn_2=0$
\\n\\nPor ello, con la condición de que
$(g_1-g_2)dn_1=0$
por lo que las funciones de Gibbs de ambas fases deben ser iguales por lo que con
| $ g_1 = g_2 $ |
ID:(3971, 0)
Ecuación de Clausius Clapeyron
Ecuación
Si se asume que en el proceso de cambio de fase la energía libre de Gibbs permanece constante se tiene que sus variaciones deben ser iguales\\n\\n
$dg_1=-s_1dT+v_1dp=-s_2dT+v_2dp=dg_2$
por lo que se puede mostrar que la presión variara en la temperatura como
La energía libre de Gibbs por mol para la fase
$g_i=u_i-Ts_i+pv_i$
\\n\\ncon
$dg_i=du_i-s_idT-Tds_i+pdv_i+v_idp$
\\n\\nCon la primera ley de la termodinámica\\n\\n
$du_i=Tds_i-pdv_i$
\\n\\nse tiene que\\n\\n
$dg_i=-s_idT+v_idp$
\\n\\nAl ser las energías libres de Gibbs por mol iguales se tiene que también lo deben ser la variaciones de estas por lo que\\n\\n
$dg_1=-s_1dT+v_1dp=-s_2dT+v_2dp=dg_2$
\\n\\nlo que se puede escribir como\\n\\n
$(s_2-s_1)dT=(v_2-v_1)dp$
o con las diferencias
| $\displaystyle\frac{dp}{dT}=\displaystyle\frac{\Delta s}{\Delta v}$ |
ID:(3972, 0)
Diagrama de fase en general
Imagen
El cambio de fase se diagrama en lo que se denomina un diagrama de fase.
En materiales puros el diagrama se caracteriza por tener tres zonas que corresponden a la fase solida, liquida y gaseosa.

Las lineas dibujadas corresponde a las combinaciones entre presión y temperatura en que cada vez dos fases pueden coexistir. Cada vez que se varia la temperatura y/o la presión de modo de atravesar una linea divisoria el sistema absorbe (paso solido a liquido/gas o paso liquido a gas) energía mientras que en el caso inverso la entrega (gas a liquido/solido o liquido a solido).
Adicionalmente se diagrama el llamado 'punto triple' marcando la combinación entre presión y temperatura que permite que las tres faces coexistan simultáneamente.
El punto critico marca el limite sobre el cual la fase liquida y gaseosas sin indistinguibles, es decir no existe una energía que marque el paso de una fase a la otra por lo que la propia diferenciación conceptual carece de sentido.
Si se estudia el comportamiento de la fase solida se va a descubrir que existen muchas veces distintas formas en que el material cristaliza lo que lleva a que la fase solida esta en realidad compuesta de una serie de fases solidas pero de distinta estructura. En este caso también existen lineas divisorias en que se marcan estados en que una o mas fases pueden coexistir y la transición entrega o absorbe energía.
El diagrama de fase también es empelado para describir materiales con impurezas que contribuyen a cambios importantes en las propiedades de los materiales. Esto es típico en metales que incluyen pequeñas cantidades de materiales como el aluminio, cobre, cromo, etc.. Existen así distintas fases de cristalización y cada una es descrita como una fase distinta.
ID:(834, 0)
Diagrama de fase del agua
Concepto
Uno de los diagramas de fase más significativos para nuestro planeta es el del agua. Este diagrama presenta las tres fases clásicas: sólido, líquido y gas, además de una variedad de fases con diferentes estructuras cristalinas del hielo.
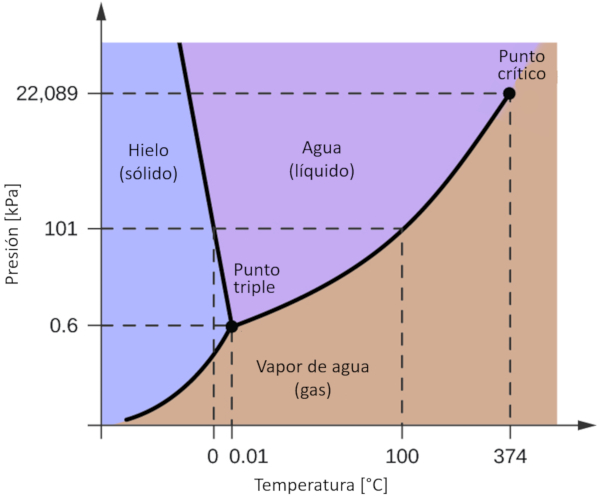
La característica más destacada en comparación con otros materiales es que en un rango de presión comprendido entre 611 Pa y 209.9 MPa, el estado sólido ocupa un volumen mayor que el estado líquido. Este fenómeno se refleja en el diagrama de fase como una pendiente negativa en la línea que separa las fases sólidas (hielo con estructura hexagonal) y líquidas (agua).
ID:(836, 0)
Calor latente
Ecuación
La diferencia de entropias
ID:(3983, 0)
Ecuación de Clausius Clapeyron y calor latente
Ecuación
Como la variación de la entropía por mol al paso de una fase a otra se puede reescribir la ecuación de Clausius Clapeyron como
Como la variación de la entropía por mol al paso de una fase a otra es
| $ \Delta l = T \Delta s $ |
la ecuación de Clausius Clapeyron
| $\displaystyle\frac{dp}{dT}=\displaystyle\frac{\Delta s}{\Delta v}$ |
se puede también escribir como
| $\displaystyle\frac{dp}{dT}=\displaystyle\frac{\Delta l}{T\Delta v}$ |
ID:(3984, 0)
