Mecanismos
Definição 
O ciclo de Otto envolve quatro estágios principais: admissão, compressão, explosão e escape. Durante a fase de admissão, o motor aspira uma mistura de combustível e ar enquanto o pistão se move para baixo. A mistura é então comprimida à medida que o pistão se move para cima, o que aumenta a temperatura e a pressão do gás. No topo do curso de compressão, a vela de ignição acende a mistura comprimida, causando uma combustão rápida conhecida como o tempo de potência. Esta combustão empurra o pistão para baixo, fornecendo energia ao motor.
Após o tempo de potência, a válvula de escape se abre e o pistão se move para cima para expelir os gases de combustão do cilindro, completando o ciclo. O motor então repete esse ciclo continuamente durante a operação.
A eficiência de um motor que opera pelo ciclo de Otto depende do grau de compressão e das propriedades do combustível usado. Relações de compressão mais altas geralmente levam a uma melhor eficiência, mas requerem combustível de maior octanagem para evitar a detonação do motor. O ciclo de Otto é caracterizado por ser um ciclo de alta velocidade com cada estágio claramente definido, contribuindo significativamente para a eficiência geral e a produção de energia dos motores que o empregam.
ID:(15282, 0)
Ciclo de Carnot
Imagem 
Sadi Carnot introduziu [1] o conceito teórico do primeiro projeto de máquina capaz de gerar trabalho mecânico com base em um gradiente de temperatura. Isso é alcançado por meio de um processo no espaço pressão-volume, onde calor é adicionado e extraído, conforme ilustrado na imagem:
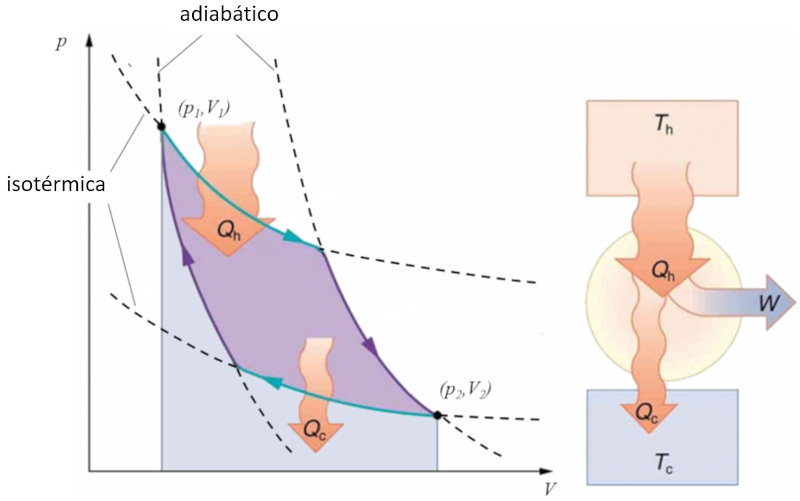
A área sob a curva o calor fornecido ($Q_H$), que se estende de 1 a 2, representa a energia necessária para transitar do estado ($p_1, V_1$) para o estado ($p_2, V_2$). Por outro lado, a área sob a curva o calor absorvido ($Q_C$), indo de 2 para 1, representa a extração de energia necessária para retornar do estado ($p_2, V_2$) ao estado ($p_1, V_1$). A diferença entre essas áreas corresponde à região delimitada por ambas as curvas e representa o trabalho eficaz ($W$) que o sistema pode realizar.
Carnot também demonstrou que, de acordo com a segunda lei da termodinâmica, o calor fornecido ($Q_H$) não pode ser igual a zero. Isso implica que não existem máquinas capazes de converter todo o calor em trabalho.
![]() [1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance" (Reflexões sobre a Potência Motriz do Fogo e sobre Máquinas Adequadas para Desenvolver Essa Potência), Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, p. 393-457 (1872)
[1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance" (Reflexões sobre a Potência Motriz do Fogo e sobre Máquinas Adequadas para Desenvolver Essa Potência), Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, p. 393-457 (1872)
ID:(11131, 0)
Ciclo Otto: diagrama pressão-volume
Nota 
O ciclo de Otto [1] pode ser considerado uma solução técnica baseada no ciclo de Carnot. Nesse contexto, ele consiste em quatro estágios que são realizados da seguinte maneira:
• Estágio 1 para 2: Compressão adiabática $(p_1,V_1,T_1)\rightarrow(p_2,V_2,T_2)$,
• Estágio 2 para 3: Aquecimento $(p_2,V_2,T_2)\rightarrow(p_3,V_2,T_3)$,
• Estágio 3 para 4: Expansão adiabática $(p_3,V_2,T_3)\rightarrow(p_4,V_1,T_4)$,
• Estágio 4 para 1: Resfriamento $(p_4,V_1,T_4)\rightarrow(p_1,V_1,T_1)$
Esses estágios são ilustrados no seguinte diagrama:
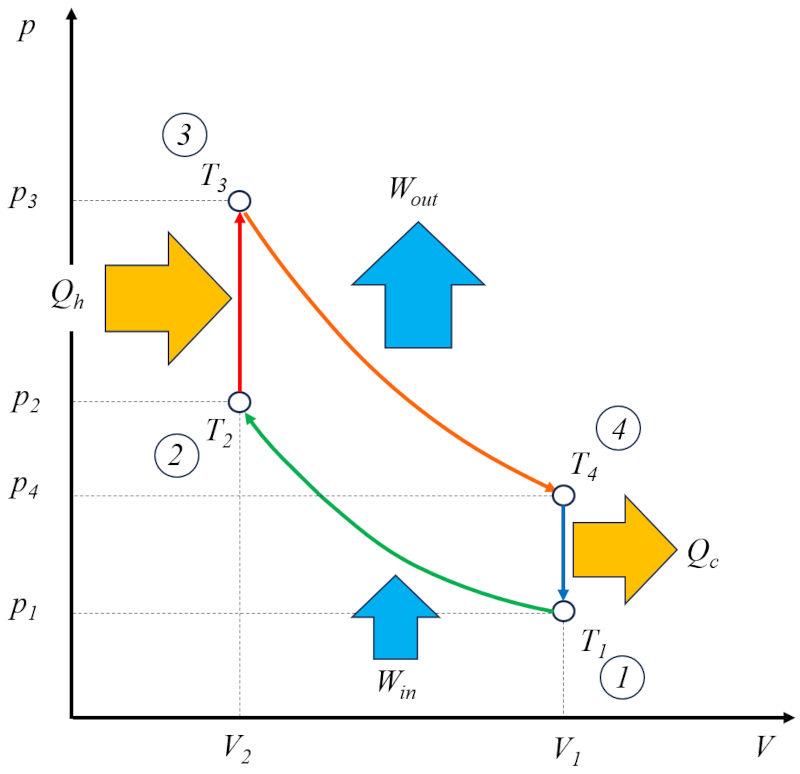
No diagrama, é ilustrado o fluxo de energia, onde o calor fornecido ($Q_H$) adiciona energia, elevando a temperatura de la temperatura no estado 2 ($T_2$) para la temperatura no estado 3 ($T_3$). Ele entra no sistema e realiza um trabalho eficaz ($W$) unidades de trabalho, enquanto o componente o calor absorvido ($Q_C$) é absorvido, diminuindo a temperatura de la temperatura no estado 4 ($T_4$) para la temperatura no estado 1 ($T_1$).
![]() [1] "Verbrennungsmotor" (Motor de combustão interna), N. A. Otto, Kaiserlichen Patentamts, Patente 532, 2 de janeiro de 1877.
[1] "Verbrennungsmotor" (Motor de combustão interna), N. A. Otto, Kaiserlichen Patentamts, Patente 532, 2 de janeiro de 1877.
Nota: Em 1862, Nikolaus Otto tentou construir o motor de combustão interna patenteado por Alphonse Beau de Rochas sem sucesso. Mais tarde, ele o modificou e conseguiu construir um funcional em 1877, fabricando 30.000 motores silenciosos e altamente confiáveis. Ele patenteou seu projeto em 1877; no entanto, a patente foi posteriormente revogada devido à existência da patente de Alphonse Beau de Rochas, embora Rochas nunca tenha conseguido construir sua versão. Como Otto foi o primeiro a fazer o motor funcionar, sua versão é lembrada hoje, denominando o processo de "Ciclo de Otto".
ID:(11140, 0)
Elementos de uma geladeira
Citar 
O motor Otto opera em dois ciclos: o ciclo Otto propriamente dito, que consiste nas seguintes fases:
• Fase 1 para 2: Compressão adiabática
• Fase 2 para 3: Aquecimento
• Fase 3 para 4: Expansão adiabática
• Fase 4 para 1: Resfriamento
Além disso, ele possui um ciclo para esvaziar os gases queimados e preencher com uma nova mistura.
Por essa razão, ele é chamado de motor de dois tempos. A fase de esvaziamento e preenchimento pode ser realizada usando uma massa de compensação ou por meio de um segundo cilindro que opera fora de fase.
A eficiência la eficiência ($\eta$) do motor pode ser estimada usando o fator de compressibilidade Otto ($r$) e o índice adiabático ($\kappa$) com a seguinte equação:
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
ID:(11142, 0)
Eficiência dependendo das temperaturas
Exercício 
O calor absorvido ($Q_C$) está relacionado com la capacidade térmica em volume constante ($C_V$), la temperatura no estado 4 ($T_4$) e la temperatura no estado 1 ($T_1$) de acordo com a seguinte equação:
| $ Q_C = C_V ( T_4 - T_1 )$ |
E O calor fornecido ($Q_H$) está relacionado com la capacidade térmica em volume constante ($C_V$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 2 ($T_2$) através da equação:
| $ Q_H = C_V ( T_3 - T_2 )$ |
Portanto, na equação para la eficiência ($\eta$) representada por:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Temos a seguinte relação:
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
ID:(15749, 0)
Eficiência em função do fator de compressibilidade
Equação 
La eficiência ($\eta$), em termos de la temperatura no estado 1 ($T_1$), la temperatura no estado 2 ($T_2$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 4 ($T_4$), é calculado usando a seguinte equação:
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
No caso de expansão adiabática, ela é descrita usando o índice adiabático ($\kappa$), o volume expandido ($V_1$) e o volume compactado ($V_2$) com a relação:
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
E a compressão adiabática é representada pela relação:
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
Se subtrairmos a segunda equação da primeira, obtemos:
$(T_4 - T_1)V_1^{\kappa-1} = (T_3 - T_2)V_2^{\kappa-1}$
O que nos leva à relação:
$\left(\displaystyle\frac{V_1}{V_2}\right)^{\kappa-1} = \displaystyle\frac{T_3 - T_2}{T_4 - T_1}$
Isso, por sua vez, leva à definição de o fator de compressibilidade Otto ($r$) com a seguinte equação:
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
Com todos esses componentes, a eficiência de um processo usando o ciclo Otto pode ser calculada como:
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
ID:(15750, 0)
Le cycle d'Otto
Descrição 
Variáveis
Cálculos
Cálculos
Equações
Seguindo uma analogia ao ERROR:5219,0 para l quidos e s lidos com la capacidade calórica ($C$) e la massa ($M$):
| $ c =\displaystyle\frac{ C }{ M }$ |
existe tamb m um calor específico dos gases a volume constante ($c_V$) para aquecimento a volume constante com la capacidade térmica em volume constante ($C_V$):
| $ c_V =\displaystyle\frac{ C_V }{ M }$ |
(ID 11113)
Ao remover o calor absorvido ($Q_C$), a temperatura do g s aumenta de $T_1$ para $T_4$ em um processo isob rico (a press o constante). Isso implica que podemos utilizar a rela o para ERROR:8085 com la capacidade térmica em volume constante ($C_V$) e ERROR:7510, que expressa pela equa o:
| $ dU = C_V \Delta T $ |
Isso nos leva aos valores de la temperatura no estado 1 ($T_1$) e la temperatura no estado 4 ($T_4$) usando a f rmula:
| $ Q_C = C_V ( T_4 - T_1 )$ |
(ID 11145)
Ao fornecer o calor fornecido ($Q_H$), a temperatura do g s aumenta de $T_2$ para $T_3$ em um processo isoc rico ( volume constante). Isso implica que podemos utilizar a rela o para ERROR:8085 com la capacidade térmica em volume constante ($C_V$) e ERROR:7510, expressa pela equa o:
| $ dU = C_V \Delta T $ |
Isso resulta nos valores de la temperatura no estado 2 ($T_2$) e la temperatura no estado 3 ($T_3$) da seguinte forma:
| $ Q_H = C_V ( T_3 - T_2 )$ |
(ID 11157)
Durante uma expans o adiab tica, o g s satisfaz a rela o envolvendo o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$) e la temperatura no estado final ($T_f$):
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Neste caso, do ponto inicial 3 ao ponto 4. Isso significa que, durante a expans o adiab tica, o estado do g s muda de o volume compactado ($V_2$) e la temperatura no estado 3 ($T_3$) para o volume expandido ($V_1$) e la temperatura no estado 4 ($T_4$), conforme:
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
(ID 11159)
Dado que em uma expans o adiab tica, o g s satisfaz a rela o com o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$) e la temperatura no estado final ($T_f$):
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Neste caso, do ponto inicial 1 ao ponto 2. Isso significa que durante a compress o adiab tica, o estado do g s muda de o volume expandido ($V_1$) e la temperatura no estado 1 ($T_1$) para o volume compactado ($V_2$) e la temperatura no estado 2 ($T_2$) da seguinte forma:
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
(ID 11160)
O calor absorvido ($Q_C$) est relacionado com la capacidade térmica em volume constante ($C_V$), la temperatura no estado 4 ($T_4$) e la temperatura no estado 1 ($T_1$) de acordo com a seguinte equa o:
| $ Q_C = C_V ( T_4 - T_1 )$ |
E O calor fornecido ($Q_H$) est relacionado com la capacidade térmica em volume constante ($C_V$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 2 ($T_2$) atrav s da equa o:
| $ Q_H = C_V ( T_3 - T_2 )$ |
Portanto, na equa o para la eficiência ($\eta$) representada por:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Temos a seguinte rela o:
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
(ID 11161)
A expans o adiab tica descrita usando as vari veis o índice adiabático ($\kappa$), la temperatura no estado 4 ($T_4$), la temperatura no estado 3 ($T_3$), o volume expandido ($V_1$) e o volume compactado ($V_2$) atrav s da rela o
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
Enquanto a compress o adiab tica representada por la temperatura no estado 1 ($T_1$) e la temperatura no estado 2 ($T_2$) atrav s da rela o
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
Subtraindo a segunda equa o da primeira, obtemos
$(T_4 - T_1)V_1^{\kappa-1} = (T_3 - T_2)V_2^{\kappa-1}$
O que nos leva rela o
$\left(\displaystyle\frac{V_1}{V_2}\right)^{\kappa-1} = \displaystyle\frac{T_3 - T_2}{T_4 - T_1}$
E isso nos permite definir o fator de compressibilidade Otto ($r$) da seguinte forma:
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
(ID 11162)
La eficiência ($\eta$), em termos de la temperatura no estado 1 ($T_1$), la temperatura no estado 2 ($T_2$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 4 ($T_4$), calculado usando a seguinte equa o:
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
No caso de expans o adiab tica, ela descrita usando o índice adiabático ($\kappa$), o volume expandido ($V_1$) e o volume compactado ($V_2$) com a rela o:
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
E a compress o adiab tica representada pela rela o:
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
Se subtrairmos a segunda equa o da primeira, obtemos:
$(T_4 - T_1)V_1^{\kappa-1} = (T_3 - T_2)V_2^{\kappa-1}$
O que nos leva rela o:
$\left(\displaystyle\frac{V_1}{V_2}\right)^{\kappa-1} = \displaystyle\frac{T_3 - T_2}{T_4 - T_1}$
Isso, por sua vez, leva defini o de o fator de compressibilidade Otto ($r$) com a seguinte equa o:
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
Com todos esses componentes, a efici ncia de um processo usando o ciclo Otto pode ser calculada como:
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
.
(ID 11163)
Exemplos
O ciclo de Otto envolve quatro est gios principais: admiss o, compress o, explos o e escape. Durante a fase de admiss o, o motor aspira uma mistura de combust vel e ar enquanto o pist o se move para baixo. A mistura ent o comprimida medida que o pist o se move para cima, o que aumenta a temperatura e a press o do g s. No topo do curso de compress o, a vela de igni o acende a mistura comprimida, causando uma combust o r pida conhecida como o tempo de pot ncia. Esta combust o empurra o pist o para baixo, fornecendo energia ao motor.
Ap s o tempo de pot ncia, a v lvula de escape se abre e o pist o se move para cima para expelir os gases de combust o do cilindro, completando o ciclo. O motor ent o repete esse ciclo continuamente durante a opera o.
A efici ncia de um motor que opera pelo ciclo de Otto depende do grau de compress o e das propriedades do combust vel usado. Rela es de compress o mais altas geralmente levam a uma melhor efici ncia, mas requerem combust vel de maior octanagem para evitar a detona o do motor. O ciclo de Otto caracterizado por ser um ciclo de alta velocidade com cada est gio claramente definido, contribuindo significativamente para a efici ncia geral e a produ o de energia dos motores que o empregam.
(ID 15282)
Sadi Carnot introduziu [1] o conceito te rico do primeiro projeto de m quina capaz de gerar trabalho mec nico com base em um gradiente de temperatura. Isso alcan ado por meio de um processo no espa o press o-volume, onde calor adicionado e extra do, conforme ilustrado na imagem:

A rea sob a curva o calor fornecido ($Q_H$), que se estende de 1 a 2, representa a energia necess ria para transitar do estado ($p_1, V_1$) para o estado ($p_2, V_2$). Por outro lado, a rea sob a curva o calor absorvido ($Q_C$), indo de 2 para 1, representa a extra o de energia necess ria para retornar do estado ($p_2, V_2$) ao estado ($p_1, V_1$). A diferen a entre essas reas corresponde regi o delimitada por ambas as curvas e representa o trabalho eficaz ($W$) que o sistema pode realizar.
Carnot tamb m demonstrou que, de acordo com a segunda lei da termodin mica, o calor fornecido ($Q_H$) n o pode ser igual a zero. Isso implica que n o existem m quinas capazes de converter todo o calor em trabalho.
![]() [1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflex es sobre a Pot ncia Motriz do Fogo e sobre M quinas Adequadas para Desenvolver Essa Pot ncia), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
[1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflex es sobre a Pot ncia Motriz do Fogo e sobre M quinas Adequadas para Desenvolver Essa Pot ncia), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
(ID 11131)
O ciclo de Otto [1] pode ser considerado uma solu o t cnica baseada no ciclo de Carnot. Nesse contexto, ele consiste em quatro est gios que s o realizados da seguinte maneira:
• Est gio 1 para 2: Compress o adiab tica $(p_1,V_1,T_1)\rightarrow(p_2,V_2,T_2)$,
• Est gio 2 para 3: Aquecimento $(p_2,V_2,T_2)\rightarrow(p_3,V_2,T_3)$,
• Est gio 3 para 4: Expans o adiab tica $(p_3,V_2,T_3)\rightarrow(p_4,V_1,T_4)$,
• Est gio 4 para 1: Resfriamento $(p_4,V_1,T_4)\rightarrow(p_1,V_1,T_1)$
Esses est gios s o ilustrados no seguinte diagrama:

No diagrama, ilustrado o fluxo de energia, onde o calor fornecido ($Q_H$) adiciona energia, elevando a temperatura de la temperatura no estado 2 ($T_2$) para la temperatura no estado 3 ($T_3$). Ele entra no sistema e realiza um trabalho eficaz ($W$) unidades de trabalho, enquanto o componente o calor absorvido ($Q_C$) absorvido, diminuindo a temperatura de la temperatura no estado 4 ($T_4$) para la temperatura no estado 1 ($T_1$).
![]() [1] "Verbrennungsmotor" (Motor de combust o interna), N. A. Otto, Kaiserlichen Patentamts, Patente 532, 2 de janeiro de 1877.
[1] "Verbrennungsmotor" (Motor de combust o interna), N. A. Otto, Kaiserlichen Patentamts, Patente 532, 2 de janeiro de 1877.
Nota: Em 1862, Nikolaus Otto tentou construir o motor de combust o interna patenteado por Alphonse Beau de Rochas sem sucesso. Mais tarde, ele o modificou e conseguiu construir um funcional em 1877, fabricando 30.000 motores silenciosos e altamente confi veis. Ele patenteou seu projeto em 1877; no entanto, a patente foi posteriormente revogada devido exist ncia da patente de Alphonse Beau de Rochas, embora Rochas nunca tenha conseguido construir sua vers o. Como Otto foi o primeiro a fazer o motor funcionar, sua vers o lembrada hoje, denominando o processo de "Ciclo de Otto".
(ID 11140)
O motor Otto opera em dois ciclos: o ciclo Otto propriamente dito, que consiste nas seguintes fases:
• Fase 1 para 2: Compress o adiab tica
• Fase 2 para 3: Aquecimento
• Fase 3 para 4: Expans o adiab tica
• Fase 4 para 1: Resfriamento
Al m disso, ele possui um ciclo para esvaziar os gases queimados e preencher com uma nova mistura.

Por essa raz o, ele chamado de motor de dois tempos. A fase de esvaziamento e preenchimento pode ser realizada usando uma massa de compensa o ou por meio de um segundo cilindro que opera fora de fase.
A efici ncia la eficiência ($\eta$) do motor pode ser estimada usando o fator de compressibilidade Otto ($r$) e o índice adiabático ($\kappa$) com a seguinte equa o:
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
(ID 11142)
O calor absorvido ($Q_C$) est relacionado com la capacidade térmica em volume constante ($C_V$), la temperatura no estado 4 ($T_4$) e la temperatura no estado 1 ($T_1$) de acordo com a seguinte equa o:
| $ Q_C = C_V ( T_4 - T_1 )$ |
E O calor fornecido ($Q_H$) est relacionado com la capacidade térmica em volume constante ($C_V$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 2 ($T_2$) atrav s da equa o:
| $ Q_H = C_V ( T_3 - T_2 )$ |
Portanto, na equa o para la eficiência ($\eta$) representada por:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Temos a seguinte rela o:
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
(ID 15749)
La eficiência ($\eta$), em termos de la temperatura no estado 1 ($T_1$), la temperatura no estado 2 ($T_2$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 4 ($T_4$), calculado usando a seguinte equa o:
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
No caso de expans o adiab tica, ela descrita usando o índice adiabático ($\kappa$), o volume expandido ($V_1$) e o volume compactado ($V_2$) com a rela o:
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
E a compress o adiab tica representada pela rela o:
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
Se subtrairmos a segunda equa o da primeira, obtemos:
$(T_4 - T_1)V_1^{\kappa-1} = (T_3 - T_2)V_2^{\kappa-1}$
O que nos leva rela o:
$\left(\displaystyle\frac{V_1}{V_2}\right)^{\kappa-1} = \displaystyle\frac{T_3 - T_2}{T_4 - T_1}$
Isso, por sua vez, leva defini o de o fator de compressibilidade Otto ($r$) com a seguinte equa o:
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
Com todos esses componentes, a efici ncia de um processo usando o ciclo Otto pode ser calculada como:
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
(ID 15750)
(ID 15341)
Neste caso, do ponto inicial 1 ao ponto 2. Isso significa que durante a compress o adiab tica, o estado do g s muda de o volume expandido ($V_1$) e la temperatura no estado 1 ($T_1$) para o volume compactado ($V_2$) e la temperatura no estado 2 ($T_2$) da seguinte forma:
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
(ID 11160)
O calor fornecido ($Q_H$) pode ser calculado a partir de la capacidade térmica em volume constante ($C_V$), la temperatura no estado 2 ($T_2$) e la temperatura no estado 3 ($T_3$) usando a f rmula:
| $ Q_H = C_V ( T_3 - T_2 )$ |
(ID 11157)
Neste caso, do ponto inicial 3 ao ponto 4. Isso significa que, durante a expans o adiab tica, o estado do g s muda de o volume compactado ($V_2$) e la temperatura no estado 3 ($T_3$) para o volume expandido ($V_1$) e la temperatura no estado 4 ($T_4$), conforme:
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
.
(ID 11159)
O calor absorvido ($Q_C$) pode ser calculado a partir de la capacidade térmica em volume constante ($C_V$), la temperatura no estado 4 ($T_4$) e la temperatura no estado 1 ($T_1$) usando a f rmula:
| $ Q_C = C_V ( T_4 - T_1 )$ |
(ID 11145)
La eficiência ($\eta$) uma fun o de la temperatura no estado 1 ($T_1$), la temperatura no estado 2 ($T_2$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 4 ($T_4$) igual a :
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
(ID 11161)
La eficiência ($\eta$) , em ltima inst ncia, uma fun o de o volume expandido ($V_1$) e o volume compactado ($V_2$), e em particular, de o fator de compressibilidade Otto ($r$):
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
(ID 11162)
La eficiência ($\eta$) pode ser calculado a partir de o fator de compressibilidade Otto ($r$) e o índice adiabático ($\kappa$) no caso do ciclo Otto usando:
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
(ID 11163)
O calor específico dos gases a volume constante ($c_V$) igual a la capacidade térmica em volume constante ($C_V$) dividido por la massa ($M$):
| $ c_V =\displaystyle\frac{ C_V }{ M }$ |
(ID 11113)
ID:(1486, 0)
