Allgemeines Gesetz der idealen Gase
Storyboard 
Die drei Gasgesetze (Boyle-Mariottes Gesetz, Charles-Gesetz, Gay-Lussacs Gesetz) und das Avogadro-Prinzip können zu einem einzigen Gesetz kombiniert werden, das als das Gesetz der idealen Gase bezeichnet wird.
Dies ermöglicht es, die Variation eines der Parameter, die den Zustand des Gases definieren (die Druck ($p$), der Volumen ($V$), die Absolute Temperatur ($T$) und der Anzahl der Mol ($n$)), für ein ideales Gas vorherzusagen, basierend auf dem Anfangszustand und jedem Endzustand, der durch die verbleibenden drei Variablen definiert ist.
ID:(1476, 0)
Allgemeines Gesetz der idealen Gase
Storyboard 
Die drei Gasgesetze (Boyle-Mariottes Gesetz, Charles-Gesetz, Gay-Lussacs Gesetz) und das Avogadro-Prinzip können zu einem einzigen Gesetz kombiniert werden, das als das Gesetz der idealen Gase bezeichnet wird. Dies ermöglicht es, die Variation eines der Parameter, die den Zustand des Gases definieren (5224, 5226, 5177 und 9339), für ein ideales Gas vorherzusagen, basierend auf dem Anfangszustand und jedem Endzustand, der durch die verbleibenden drei Variablen definiert ist.
Variablen
Berechnungen
Berechnungen
Gleichungen
Die Druck ($p$), der Volumen ($V$), die Absolute Temperatur ($T$) und der Anzahl der Mol ($n$) stehen im Zusammenhang mit den folgenden physikalischen Gesetzen:
• Das Gesetz von Boyle
• Das Gesetz von Charles
• Das Gesetz von Gay-Lussac
• Das Gesetz von Avogadro
Diese Gesetze k nnen in einer allgemeineren Form ausgedr ckt werden:
$\displaystyle\frac{pV}{nT}=cte$
Diese allgemeine Beziehung besagt, dass das Produkt aus Druck und Volumen durch die Anzahl der Mol und die Temperatur geteilt konstant bleibt:
Die Druck ($p$), der Volumen ($V$), die Absolute Temperatur ($T$) und der Anzahl der Mol ($n$) stehen im Zusammenhang mit den folgenden physikalischen Gesetzen:
• Das Gesetz von Boyle
• Das Gesetz von Charles
• Das Gesetz von Gay-Lussac
• Das Gesetz von Avogadro
Diese Gesetze k nnen in einer allgemeineren Form ausgedr ckt werden:
$\displaystyle\frac{pV}{nT}=cte$
Diese allgemeine Beziehung besagt, dass das Produkt aus Druck und Volumen durch die Anzahl der Mol und die Temperatur geteilt konstant bleibt:
Wenn die Druck ($p$) sich wie ein ideales Gas verh lt und der Volumen ($V$), der Anzahl der Mol ($n$), die Absolute Temperatur ($T$) und die Universelle Gas Konstante ($R_C$) erf llt, f hrt die ideale Gasgleichung:
und die Definition von die Molare Konzentration ($c_m$):
zu folgender Beziehung:
Wenn die Druck ($p$) sich wie ein ideales Gas verh lt und der Volumen ($V$), der Anzahl der Mol ($n$), die Absolute Temperatur ($T$) und die Universelle Gas Konstante ($R_C$) erf llt, f hrt die ideale Gasgleichung:
und die Definition von die Molare Konzentration ($c_m$):
zu folgender Beziehung:
Die Druck ($p$) ist durch die Gleichung mit der Volumen ($V$), ERROR:6679, die Absolute Temperatur ($T$) und die Universelle Gas Konstante ($R_C$) verbunden:
Da ERROR:6679 mit die Masse ($M$) und die Molmasse ($M_m$) berechnet werden kann mittels:
und durch die Definition von die Spezifische Gaskonstante ($R_s$) mit:
folgern wir:
Die Druck ($p$) ist durch die Gleichung mit der Volumen ($V$), ERROR:6679, die Absolute Temperatur ($T$) und die Universelle Gas Konstante ($R_C$) verbunden:
Da ERROR:6679 mit die Masse ($M$) und die Molmasse ($M_m$) berechnet werden kann mittels:
und durch die Definition von die Spezifische Gaskonstante ($R_s$) mit:
folgern wir:
Wenn wir die Gleichung f r Gase einf hren, die mit die Druck ($p$), der Volumen ($V$), die Masse ($M$), die Spezifische Gaskonstante ($R_s$) und die Absolute Temperatur ($T$) geschrieben ist als:
und die Definition die Dichte ($\rho$) verwenden, die gegeben ist durch:
k nnen wir eine spezifische Gleichung f r Gase ableiten, wie folgt:
Wenn wir die Gleichung f r Gase einf hren, die mit die Druck ($p$), der Volumen ($V$), die Masse ($M$), die Spezifische Gaskonstante ($R_s$) und die Absolute Temperatur ($T$) geschrieben ist als:
und die Definition die Dichte ($\rho$) verwenden, die gegeben ist durch:
k nnen wir eine spezifische Gleichung f r Gase ableiten, wie folgt:
Das ideale Gasgesetz wird ausgedr ckt als
und kann geschrieben werden als
$\displaystyle\frac{pV}{nT} = R$
Dies impliziert, dass die Anfangs- und Endbedingungen die Gleichheit erf llen m ssen
$\displaystyle\frac{p_iV_i}{n_iT_i} = R = \displaystyle\frac{p_fV_f}{n_fT_f}$
Somit erhalten wir die folgende Gleichung:
Beispiele
Das universelle Gasgesetz, auch bekannt als das ideale Gasgesetz, beschreibt die Beziehung zwischen Druck, Volumen, Temperatur und der Anzahl der Mole von einem Gas. Es kombiniert mehrere Gasgesetze, einschlie lich des Boyle'schen Gesetzes, des Gesetzes von Charles und des Avogadro-Prinzips, in einer einzigen Gleichung. Dieses Gesetz besagt, dass das Produkt aus Druck und Volumen eines Gases direkt proportional zum Produkt aus Temperatur und der Anzahl der Mole des Gases ist. Das ideale Gasgesetz geht davon aus, dass Gase aus einer gro en Anzahl von Molek len bestehen, die sich in st ndiger, zuf lliger Bewegung befinden, und dass die Wechselwirkungen zwischen diesen Molek len vernachl ssigbar sind. Dieses Gesetz ist grundlegend, um das Verhalten von Gasen unter verschiedenen Bedingungen vorherzusagen, und wird sowohl in der wissenschaftlichen Forschung als auch in praktischen Anwendungen wie Ingenieurwesen und Chemie weit verbreitet verwendet.
Der Zustand eines Systems wird durch die sogenannte Zustandsgleichung beschrieben, die die Beziehung zwischen den Parametern festlegt, die das System charakterisieren.
Im Fall von Gasen sind die Parameter, die ihren Zustand beschreiben, die Druck ($p$), der Volumen ($V$), die Absolute Temperatur ($T$) und der Anzahl der Mol ($n$). In der Regel bleibt der letzte Parameter konstant, da er mit der Menge des vorhandenen Gases zusammenh ngt.
Die Zustandsgleichung verkn pft daher Druck, Volumen und Temperatur und legt fest, dass es nur zwei Freiheitsgrade gibt, da die Zustandsgleichung die Berechnung des dritten Parameters erm glicht. Insbesondere, wenn das Volumen festgelegt ist, kann man beispielsweise die Temperatur als Variable w hlen, was die Berechnung des entsprechenden Drucks erm glicht.
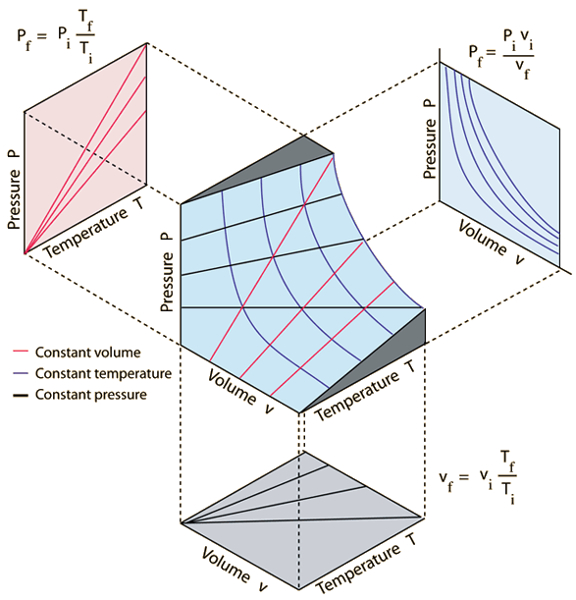
Die drei Gasgesetze, die mit die Druck ($p$), der Volumen ($V$) und die Absolute Temperatur ($T$) in Beziehung stehen, sind:
• Das Gesetz von Boyle, das besagt, dass bei konstanter Temperatur das Produkt aus Druck und Volumen eines Gases konstant ist:
• Das Gesetz von Charles, das besagt, dass bei konstantem Druck das Volumen eines Gases direkt proportional zur absoluten Temperatur ist:
• Das Gesetz von Gay-Lussac, das besagt, dass bei konstantem Volumen der Druck eines Gases direkt proportional zur absoluten Temperatur ist:
Diese Gesetze k nnen graphisch wie in der folgenden Abbildung dargestellt werden:
Im Jahr 1834 erkannte mile Clapeyron [1], dass die Druck ($p$), der Volumen ($V$), die Absolute Temperatur ($T$) und der Anzahl der Mol ($n$) durch das Boyle'sche Gesetz, das Charles'sche Gesetz, das Gesetz von Gay-Lussac und das Avogadro-Gesetz miteinander verbunden sind. Diese Gesetze k nnen allgemeiner ausgedr ckt werden als:
$\displaystyle\frac{pV}{nT} = \text{konstant}$
Diese allgemeine Beziehung besagt, dass das Produkt von Druck und Volumen, geteilt durch die Anzahl der Mole und die Temperatur, konstant bleibt:
In dieser Gleichung nimmt die Universelle Gas Konstante ($R_C$) den Wert von 8,314 J/K mol an.
[1] "M moire sur la puissance motrice de la chaleur" (Abhandlung ber die treibende Kraft der W rme), mile Clapeyron, Journal de l' cole Polytechnique, 1834.
Das ideale Gasgesetz wird ausgedr ckt als
und kann geschrieben werden als
$\displaystyle\frac{pV}{nT} = R$
Dies impliziert, dass die Anfangs- und Endbedingungen die Gleichheit erf llen m ssen
$\displaystyle\frac{p_iV_i}{n_iT_i} = R = \displaystyle\frac{p_fV_f}{n_fT_f}$
Somit erhalten wir die folgende Gleichung:
Wenn die Druck ($p$) sich wie ein ideales Gas verh lt und der Volumen ($V$), der Anzahl der Mol ($n$), die Absolute Temperatur ($T$) und die Universelle Gas Konstante ($R_C$) erf llt, f hrt die ideale Gasgleichung:
und die Definition von die Molare Konzentration ($c_m$):
zu folgender Beziehung:
Die Druck ($p$) ist durch die Gleichung mit der Volumen ($V$), ERROR:6679, die Absolute Temperatur ($T$) und die Universelle Gas Konstante ($R_C$) verbunden:
Da ERROR:6679 mit die Masse ($M$) und die Molmasse ($M_m$) berechnet werden kann mittels:
und durch die Definition von die Spezifische Gaskonstante ($R_s$) mit:
folgern wir:
Wenn wir die Gleichung f r Gase einf hren, die mit die Druck ($p$), der Volumen ($V$), die Masse ($M$), die Spezifische Gaskonstante ($R_s$) und die Absolute Temperatur ($T$) geschrieben ist als:
und die Definition die Dichte ($\rho$) verwenden, die gegeben ist durch:
k nnen wir eine spezifische Gleichung f r Gase ableiten, wie folgt:
Die Druck ($p$), der Volumen ($V$), die Absolute Temperatur ($T$) und der Anzahl der Mol ($n$) sind durch die folgende Gleichung verbunden:
wobei die Universelle Gas Konstante ($R_C$) einen Wert von 8,314 J/K mol hat.
Die Druck ($p$), der Volumen ($V$), die Absolute Temperatur ($T$) und der Anzahl der Mol ($n$) sind durch die folgende Gleichung verbunden:
wobei die Universelle Gas Konstante ($R_C$) einen Wert von 8,314 J/K mol hat.
F r einen Anfangszustand (die Druck im Ausgangszustand ($p_i$), der Volumen im Zustand i ($V_i$), die Temperatur im Ausgangszustand ($T_i$) und der Anzahl der Maulwürfe im Staat i ($n_i$)) und einen Endzustand (die Druck im Endzustand ($p_f$), der Volumen im Zustand f ($V_f$), die Temperatur im Endzustand ($T_f$) und der Anzahl der Maulwürfe im Staat f ($n_f$)) gilt:
Die Druck ($p$) kann aus die Molare Konzentration ($c_m$) unter Verwendung von die Absolute Temperatur ($T$) und die Universelle Gas Konstante ($R_C$) wie folgt berechnet werden:
Die Druck ($p$) kann aus die Molare Konzentration ($c_m$) unter Verwendung von die Absolute Temperatur ($T$) und die Universelle Gas Konstante ($R_C$) wie folgt berechnet werden:
Die Druck ($p$) steht in Beziehung zu die Masse ($M$) mit der Volumen ($V$), die Spezifische Gaskonstante ($R_s$) und die Absolute Temperatur ($T$) durch:
Die Druck ($p$) steht in Beziehung zu die Masse ($M$) mit der Volumen ($V$), die Spezifische Gaskonstante ($R_s$) und die Absolute Temperatur ($T$) durch:
Wenn man mit den spezifischen Daten eines Gases arbeitet, kann die Spezifische Gaskonstante ($R_s$) in Abh ngigkeit von die Universelle Gas Konstante ($R_C$) und die Molmasse ($M_m$) wie folgt definiert werden:
Wenn wir mit der Masse oder die Dichte ($\rho$) des Gases arbeiten, k nnen wir eine Gleichung aufstellen, die analog zu der f r ideale Gase f r die Druck ($p$) und die Absolute Temperatur ($T$) ist, wobei der einzige Unterschied darin besteht, dass die Konstante f r jeden Gastype spezifisch ist und als die Spezifische Gaskonstante ($R_s$) bezeichnet wird:
Wenn wir mit der Masse oder die Dichte ($\rho$) des Gases arbeiten, k nnen wir eine Gleichung aufstellen, die analog zu der f r ideale Gase f r die Druck ($p$) und die Absolute Temperatur ($T$) ist, wobei der einzige Unterschied darin besteht, dass die Konstante f r jeden Gastype spezifisch ist und als die Spezifische Gaskonstante ($R_s$) bezeichnet wird:
ID:(1476, 0)