Le Cycle Diesel
Storyboard 
Variables
Calculs
Calculs
Équations
En suivant une analogie avec le ERROR:5219,0 pour les liquides et les solides avec a capacité calorique ($C$) et a masse ($M$) :
il existe galement un chaleur spécifique des gaz à volume constant ($c_V$) pour le chauffage volume constant avec a capacité thermique à volume constant ($C_V$) :
En suivant une analogie avec le ERROR:5219,0 pour les liquides et les solides avec a capacité calorique ($C$) et a masse ($M$) :
il existe galement un chaleur spécifique à pression constante ($c_p$) pour le chauffage pression constante avec a capacité thermique à pression constante ($C_p$) :
Lorsque l'on fournit le chaleur fournie ($Q_H$), la temp rature du gaz augmente de $T_2$ $T_3$ au cours d'un processus isobare ( pression constante). Cela implique que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à pression constante ($C_p$) et ERROR:7510, exprim e par l' quation :
Cela nous conduit aux valeurs de a température à l'état 3 ($T_3$) et a température à l'état 2 ($T_2$) en utilisant la formule :
Lors du retrait de le chaleur absorbée ($Q_C$), la temp rature du gaz augmente de $T_1$ $T_4$ dans un processus isobare ( pression constante). Cela implique que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, qui est exprim e par l' quation :
Cela nous am ne aux valeurs de a température à l'état 1 ($T_1$) et a température à l'état 4 ($T_4$) en utilisant la formule :
tant donn qu'en cas d'expansion adiabatique, le gaz satisfait aux relations le volume à l'état i ($V_i$), le volume à l'état f ($V_f$), a température à l'état initial ($T_i$), a température à l'état final ($T_f$) et le indice adiabatique ($\kappa$), exprim es comme suit :
Nous pouvons noter que lors du changement d' tat de le volume étendu ($V_1$) et a température à l'état 1 ($T_1$) Le volume compressé ($V_2$) et a température à l'état 2 ($T_2$), l' galit suivante est v rifi e :
$T_1V_1^{\kappa-1}=T_2V_2^{\kappa-1}$
En utilisant l' quation pour le entropie molaire de la vapeur ($r_C$) :
Nous obtenons :
tant donn qu'en cas d'expansion adiabatique, le gaz satisfait aux relations le volume à l'état i ($V_i$), le volume à l'état f ($V_f$), a température à l'état initial ($T_i$), a température à l'état final ($T_f$), et le indice adiabatique ($\kappa$), exprim es comme suit :
Nous pouvons observer que lors du changement d' tat de le volume intermédiaire ($V_3$) et a température à l'état 3 ($T_3$) Le volume étendu ($V_1$) et a température à l'état 4 ($T_4$), l' galit suivante est v rifi e :
$T_3V_3^{\kappa-1}=T_4V_1^{\kappa-1}$
En utilisant l' quation pour le facteur d'extensibilité ($r_E$) :
Nous obtenons :
Comme le r chauffement se produit pression constante, la loi de Charles s'applique :
Ainsi, le changement d' tat ($V_2, T_2$) ($V_3, T_3$) doit satisfaire l' quation :
$\displaystyle\frac{T_2}{V_2} = \displaystyle\frac{T_3}{V_3}$
Avec les quations :
nous pouvons r crire comme suit :
$T_3 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_1} \displaystyle\frac{V_1}{V_2} T_2 = \displaystyle\frac{r_C}{r_E} T_2$
c'est- -dire :
La valeur de a efficacité ($\eta$) peut tre calcul e l'aide des valeurs le indice adiabatique ($\kappa$), a température à l'état 1 ($T_1$), a température à l'état 2 ($T_2$), a température à l'état 3 ($T_3$) et a température à l'état 4 ($T_4$) dans l' quation suivante :
De plus, les relations entre les temp ratures avec le entropie molaire de la vapeur ($r_C$) et le facteur d'extensibilité ($r_E$) sont d finies par les quations suivantes :
De plus, la valeur de le indice adiabatique ($\kappa$) est utilis e dans l' quation :
Ces quations nous permettent de calculer la performance d'un processus suivant le cycle Diesel l'aide de l' quation suivante :
Lors d'une expansion adiabatique, le gaz respecte la relation impliquant le volume à l'état i ($V_i$), le volume à l'état f ($V_f$), a température à l'état initial ($T_i$) et a température à l'état final ($T_f$) :
Dans ce cas, du point initial 3 au point 4. Cela signifie que pendant l'expansion adiabatique, l' tat du gaz change de le volume compressé ($V_2$) et a température à l'état 3 ($T_3$) Le volume étendu ($V_1$) et a température à l'état 4 ($T_4$) selon :
tant donn qu'en expansion adiabatique, le gaz satisfait la relation avec le volume à l'état i ($V_i$), le volume à l'état f ($V_f$), a température à l'état initial ($T_i$) et a température à l'état final ($T_f$) :
Dans ce cas, du point initial 1 au point 2. Cela signifie que pendant la compression adiabatique, l' tat du gaz passe de le volume étendu ($V_1$) et a température à l'état 1 ($T_1$) Le volume compressé ($V_2$) et a température à l'état 2 ($T_2$) comme suit :
L'efficacit en fonction de la temp rature est d finie par :
avec les quantit s de chaleur fournies :
et absorb es :
nous avons la relation d'efficacit en fonction de la temp rature :
Exemples
Le cycle Diesel est un cycle thermodynamique qui sous-tend le fonctionnement des moteurs diesel, largement utilis s dans les v hicules et les machines industrielles. D velopp par Rudolf Diesel dans les ann es 1890, ce cycle se distingue principalement de celui d'Otto, utilis dans les moteurs essence, par son processus d'allumage. Dans le cycle Diesel, l'air est aspir dans le cylindre et comprim un taux beaucoup plus lev que dans les moteurs essence, ce qui l ve sa temp rature un niveau suffisant pour enflammer le carburant diesel sans n cessiter de bougie d'allumage.
Lors de son fonctionnement, le cycle commence par l'admission d'air lorsque le piston descend. L'air est ensuite comprim lors de la remont e du piston, augmentant sa temp rature. Au sommet de la phase de compression, du carburant est inject dans l'air comprim et chaud sous forme de fine brume, provoquant une ignition spontan e. La combustion pousse le piston vers le bas, g n rant ainsi de l' nergie. Enfin, lors de la phase d' chappement, les gaz de combustion sont expuls s lorsque le piston remonte, compl tant ainsi le cycle.
Les moteurs Diesel sont reconnus pour leur efficacit et leur durabilit . Le haut taux de compression permet non seulement d'extraire plus d' nergie du carburant, mais augmente galement l'efficience thermique, signifiant qu'une plus grande partie de l' nergie du carburant est convertie en travail m canique. Les moteurs Diesel offrent g n ralement une meilleure efficacit nerg tique et produisent moins d' missions de CO2 par unit d' nergie que leurs homologues essence, mais ils peuvent mettre des niveaux plus lev s d'autres polluants, tels que les oxydes d'azote et les particules.
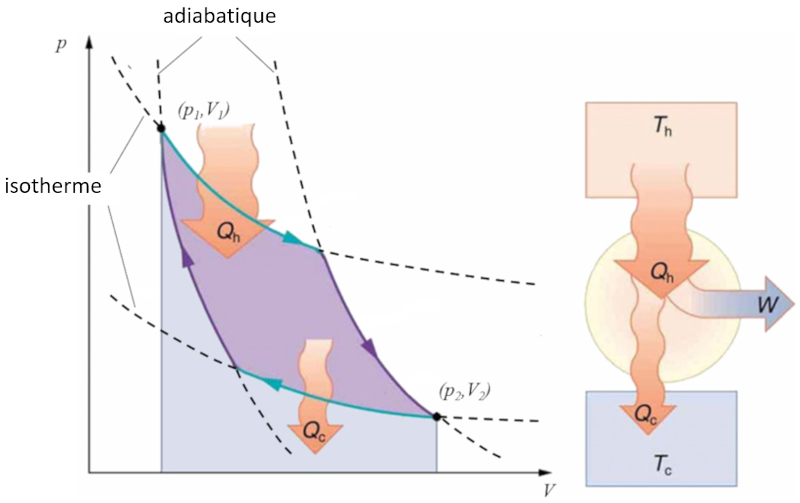
Sadi Carnot a introduit [1] le concept th orique du premier projet de machine capable de g n rer du travail m canique bas sur un gradient de temp rature. Cela est r alis gr ce un processus dans l'espace pression-volume o la chaleur est ajout e et extraite, comme illustr dans l'image :
La zone sous la courbe le chaleur fournie ($Q_H$), s' tendant de 1 2, repr sente l' nergie n cessaire pour passer de l' tat ($p_1, V_1$) l' tat ($p_2, V_2$). En revanche, la zone sous la courbe le chaleur absorbée ($Q_C$), allant de 2 1, repr sente l'extraction d' nergie n cessaire pour revenir de l' tat ($p_2, V_2$) l' tat ($p_1, V_1$). La diff rence entre ces zones correspond la r gion d limit e par les deux courbes et repr sente le travail efficace ($W$) que le syst me peut accomplir.
Carnot a galement d montr que, conform ment au deuxi me principe de la thermodynamique, le chaleur fournie ($Q_H$) ne peut pas tre nul. Cela implique qu'il n'existe pas de machines capables de convertir toute la chaleur en travail.
![]() [1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance", Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
[1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance", Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
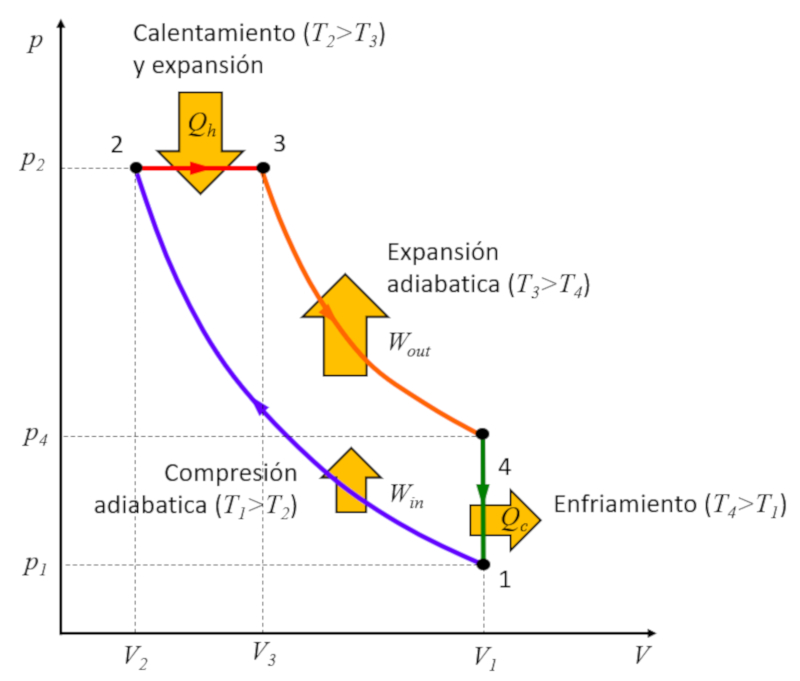
Rudolf Diesel [1] s'est lanc dans la cr ation d'un cycle diff rent du cycle de Carnot dans le but d'atteindre une meilleure efficacit par rapport au cycle de Otto. Ce processus se d roule en plusieurs tapes :
• tape 1 2 : Compression adiabatique $(p_1,V_1,T_1)\rightarrow (p_2,V_2,T_2)$,
• tape 2 3 : Chauffage et expansion pression constante $(p_2,V_2,T_2)\rightarrow (p_2,V_3,T_3)$,
• tape 3 4 : Expansion adiabatique $(p_2,V_3,T_3)\rightarrow (p_3,V_1,T_4)$,
• tape 4 1 : Refroidissement volume constant $(p_3,V_1,T_4)\rightarrow (p_1,V_1,T_1)$
Ces tapes sont illustr es ci-dessous :
La cl r side dans l' tape 2 3, o l'expansion se produit pression constante. La raison en devient vidente en examinant le graphique :
L' nergie gagn e est gale la surface l'int rieur du cycle, et en effectuant la compression pression constante, cette surface est plus grande que dans le cas de la compression volume constant.
![]() [1] "Verfahren zur Entwickelung eines rationellen W rmemotors zum Ersatz der Dampfmaschine und der heute bekannten Verbrennungsmotoren" (M thode pour le D veloppement d'un Moteur Thermique Rationnel pour Remplacer la Machine Vapeur et les Moteurs Combustion Contemporains), Rudolf Diesel, Kaiserlichen Patentamts, No. 67207 (1892)
[1] "Verfahren zur Entwickelung eines rationellen W rmemotors zum Ersatz der Dampfmaschine und der heute bekannten Verbrennungsmotoren" (M thode pour le D veloppement d'un Moteur Thermique Rationnel pour Remplacer la Machine Vapeur et les Moteurs Combustion Contemporains), Rudolf Diesel, Kaiserlichen Patentamts, No. 67207 (1892)
Tant le cycle Otto que le cycle Diesel d pendent des variables a température à l'état 1 ($T_1$), a température à l'état 2 ($T_2$), a température à l'état 3 ($T_3$) et a température à l'état 4 ($T_4$). Cependant, dans le cas du cycle Diesel, il d pend galement de le indice adiabatique ($\kappa$), dont la valeur est de 1,4.
Dans le cycle Otto, l'efficacit est calcul e en fonction de la temp rature l'aide de l' quation suivante :
Alors que dans le cycle Diesel, l'efficacit est calcul e en fonction de la temp rature l'aide de l' quation suivante :
L'inclusion du facteur $1/\kappa \sim 0,71$ dans le cycle Diesel le rend plus efficace par rapport au cycle Otto pour la m me configuration de temp rature. Cela r sulte directement de l'agrandissement de la zone contenue dans la courbe qui repr sente le cycle dans la repr sentation pression-volume.
tant donn qu'en cas d'expansion adiabatique, le gaz satisfait aux relations le volume à l'état i ($V_i$), le volume à l'état f ($V_f$), a température à l'état initial ($T_i$), a température à l'état final ($T_f$), et le indice adiabatique ($\kappa$), exprim es comme suit :
Nous pouvons observer que lors du changement d' tat de le volume intermédiaire ($V_3$) et a température à l'état 3 ($T_3$) Le volume étendu ($V_1$) et a température à l'état 4 ($T_4$), l' galit suivante est v rifi e :
$T_3V_3^{\kappa-1}=T_4V_1^{\kappa-1}$
En utilisant l' quation pour le facteur d'extensibilité ($r_E$) :
Nous obtenons :
tant donn qu'en cas d'expansion adiabatique, le gaz satisfait aux relations le volume à l'état i ($V_i$), le volume à l'état f ($V_f$), a température à l'état initial ($T_i$), a température à l'état final ($T_f$) et le indice adiabatique ($\kappa$), exprim es comme suit :
Nous pouvons noter que lors du changement d' tat de le volume étendu ($V_1$) et a température à l'état 1 ($T_1$) Le volume compressé ($V_2$) et a température à l'état 2 ($T_2$), l' galit suivante est v rifi e :
$T_1V_1^{\kappa-1}=T_2V_2^{\kappa-1}$
En utilisant l' quation pour le entropie molaire de la vapeur ($r_C$) :
Nous obtenons :
Comme le r chauffement se produit pression constante, la loi de Charles s'applique :
Ainsi, le changement d' tat ($V_2, T_2$) ($V_3, T_3$) doit satisfaire l' quation :
$\displaystyle\frac{T_2}{V_2} = \displaystyle\frac{T_3}{V_3}$
Avec les quations :
nous pouvons r crire comme suit :
$T_3 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_1} \displaystyle\frac{V_1}{V_2} T_2 = \displaystyle\frac{r_C}{r_E} T_2$
c'est- -dire :
L'efficacit en fonction de la temp rature est d finie par :
avec les quantit s de chaleur fournies :
et absorb es :
nous avons la relation d'efficacit en fonction de la temp rature :
La valeur de a efficacité ($\eta$) peut tre calcul e l'aide des valeurs le indice adiabatique ($\kappa$), a température à l'état 1 ($T_1$), a température à l'état 2 ($T_2$), a température à l'état 3 ($T_3$) et a température à l'état 4 ($T_4$) dans l' quation suivante :
De plus, les relations entre les temp ratures avec le entropie molaire de la vapeur ($r_C$) et le facteur d'extensibilité ($r_E$) sont d finies par les quations suivantes :
De plus, la valeur de le indice adiabatique ($\kappa$) est utilis e dans l' quation :
Ces quations nous permettent de calculer la performance d'un processus suivant le cycle Diesel l'aide de l' quation suivante :
Dans ce cas, du point initial 1 au point 2. Cela signifie que pendant la compression adiabatique, l' tat du gaz passe de le volume étendu ($V_1$) et a température à l'état 1 ($T_1$) Le volume compressé ($V_2$) et a température à l'état 2 ($T_2$) comme suit :
ERROR:8xa0170 peut tre calcul avec a capacité thermique à pression constante ($C_p$), a température à l'état 3 ($T_3$) et a température à l'état 2 ($T_2$) en utilisant la formulexa0:
Dans ce cas, du point initial 3 au point 4. Cela signifie que pendant l'expansion adiabatique, l' tat du gaz change de le volume compressé ($V_2$) et a température à l'état 3 ($T_3$) Le volume étendu ($V_1$) et a température à l'état 4 ($T_4$) selon :
Le chaleur absorbée ($Q_C$) peut tre calcul partir de a capacité thermique à volume constant ($C_V$), a température à l'état 4 ($T_4$) et a température à l'état 1 ($T_1$) l'aide de la formulexa0:
Dans l'analyse du cycle Diesel, il est utile d'introduire ce que l'on appelle le entropie molaire de la vapeur ($r_C$), qui repr sente la relation entre le volume étendu ($V_1$) et le volume compressé ($V_2$) lors de la compression du m lange, comme le montre l'expression suivante :
Dans l'analyse du cycle Diesel, il est avantageux d'introduire le terme le facteur d'extensibilité ($r_E$), qui repr sente la relation entre le volume étendu ($V_1$) et le volume intermédiaire ($V_3$) pendant la compression du m lange, comme illustr dans l'expression suivante :
A température à l'état 3 ($T_3$) peut tre calcul avec a température à l'état 4 ($T_4$), le facteur d'extensibilité ($r_E$) et le indice adiabatique ($\kappa$) en utilisantxa0:
A température à l'état 2 ($T_2$) peut tre calcul partir de a température à l'état 1 ($T_1$), le entropie molaire de la vapeur ($r_C$) et le indice adiabatique ($\kappa$) en utilisantxa0:
A température à l'état 3 ($T_3$) peut tre calcul partir de a température à l'état 2 ($T_2$), le entropie molaire de la vapeur ($r_C$) et le facteur d'extensibilité ($r_E$) en utilisantxa0:
A efficacité ($\eta$) peut tre calcul partir de le indice adiabatique ($\kappa$), a température à l'état 1 ($T_1$), a température à l'état 2 ($T_2$), a température à l'état 3 ($T_3$) et 8492 en utilisantxa0:
Le calcul de a efficacité ($\eta$) est effectu en utilisant le indice adiabatique ($\kappa$), le entropie molaire de la vapeur ($r_C$) et le facteur d'extensibilité ($r_E$), comme suitxa0:
Le chaleur spécifique à pression constante ($c_p$) est gal a capacité thermique à pression constante ($C_p$) divis par a masse ($M$)xa0:
Le chaleur spécifique des gaz à volume constant ($c_V$) est gal a capacité thermique à volume constant ($C_V$) divis par a masse ($M$)xa0:
ID:(1487, 0)