Chaleur et température
Storyboard 
La chaleur correspond à l'énergie que possèdent les atomes d'un corps et peut être interprétée comme l'oscillation qu'ils effectuent autour de leur point d'équilibre.
Une mesure de cette énergie est la température du corps. Si de la chaleur est fournie à un corps, sa température augmente de manière proportionnelle. La constante de proportionnalité, que nous appelons capacité calorifique, est en elle-même une fonction de la température.
ID:(780, 0)
Chaleur et température
Storyboard 
La chaleur correspond à l'énergie que possèdent les atomes d'un corps et peut être interprétée comme l'oscillation qu'ils effectuent autour de leur point d'équilibre. Une mesure de cette énergie est la température du corps. Si de la chaleur est fournie à un corps, sa température augmente de manière proportionnelle. La constante de proportionnalité, que nous appelons capacité calorifique, est en elle-même une fonction de la température.
Variables
Calculs
Calculs
Équations
Exemples
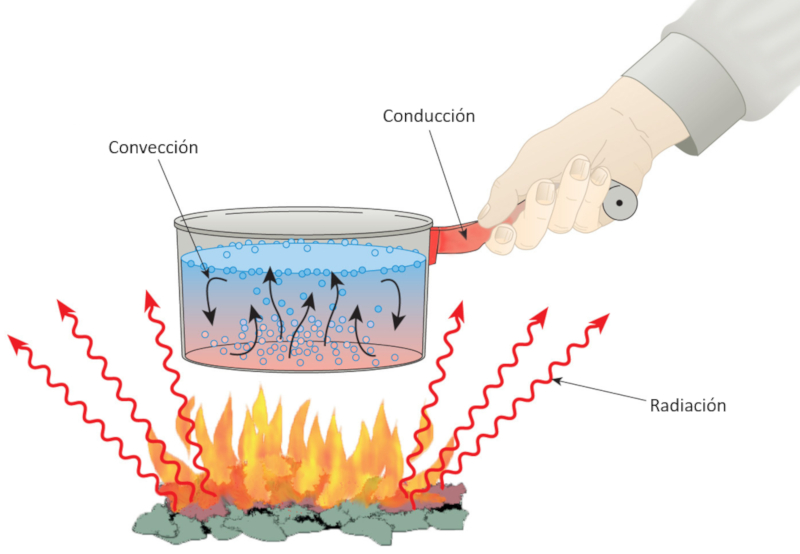
La chaleur et la temp rature sont des concepts fondamentaux en thermodynamique qui repr sentent des quantit s physiques diff rentes. La chaleur est l' nergie transf r e entre des syst mes ou des objets en raison d'une diff rence de temp rature, circulant des objets plus chauds vers les objets plus froids jusqu' ce que l' quilibre thermique soit atteint. Elle est mesur e en joules, calories ou unit s thermiques britanniques (BTU) et est consid r e comme une fonction de chemin, ce qui signifie qu'elle d pend du processus de transfert d' nergie. La chaleur peut tre transf r e par conduction, convection ou radiation.
La temp rature, en revanche, est une mesure de l' nergie cin tique moyenne des particules dans une substance, indiquant quel point un objet est chaud ou froid. Elle est mesur e en degr s Celsius, Kelvin ou Fahrenheit, le Kelvin tant l'unit du SI utilis e dans les contextes scientifiques. La temp rature est une fonction d' tat, ne d pendant que de l' tat actuel du syst me et non du processus utilis pour atteindre cet tat. Elle d termine la direction du flux de chaleur, car la chaleur se d place des r gions de temp rature plus lev e vers les r gions de temp rature plus basse.
La chaleur n'est rien d\'autre qu\'une nergie l\' chelle microscopique.
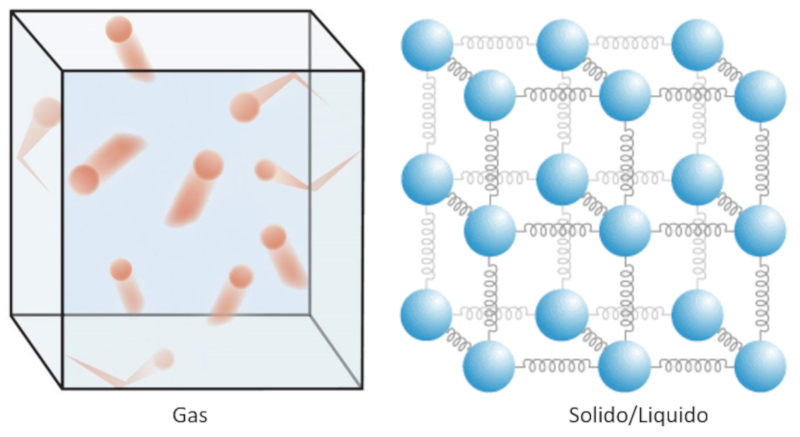
Dans le cas d\'un gaz, cela correspond principalement l\' nergie cin tique de ses mol cules.
Dans les liquides et les solides, il faut tenir compte de l\'attraction entre les atomes, ce qui fait intervenir l\' nergie potentielle. Ainsi, dans ce cas, la chaleur correspond l\' nergie que les particules poss dent et avec laquelle elles oscillent autour du point d\' quilibre d fini par les autres particules de leur environnement.
La chaleur est associ e des l ments tels que le feu, qui l ve la temp rature de l'eau. Le processus de chauffage g n re du mouvement, ce qui montre que la chaleur est li e l\' nergie m canique. M me la poign e d\'une casserole se r chauffe et notre corps est capable de percevoir cette temp rature. De plus, le feu met galement des rayonnements qui r chauffent les objets qu\'ils touchent.
Nous pouvons ainsi d duire qu\'en fournissant de la chaleur, nous pouvons augmenter la temp rature d\'un objet, et que la g n ration de mouvement est associ e l\' nergie.
La temp rature est une mesure de l' nergie contenue dans un corps et est associ e, dans les solides et les liquides, aux oscillations des mol cules/atomes, et dans les gaz et les liquides, au d placement de ces particules.
Si un syst me est initialement une température à l'état initial ($T_i$) et qu'il se trouve ensuite a température à l'état final ($T_f$), la diff rence sera de :
La diff rence de temp rature est ind pendante de savoir si ces valeurs sont en degr s Celsius ou en Kelvin.
Si un corps poss de initialement une quantit de chaleur le chaleur initiale ($Q_i$) et poss de ensuite une quantit de chaleur le chaleur finale ($Q_f$) ($Q_f > Q_i$), cela signifie que de la chaleur a t transf r e vers le corps le différence de chaleur ($\Delta Q$). En revanche, si ($Q_f < Q_i$), le corps a c d de la chaleur.
Lorsque a chaleur fournie au liquide ou au solide ($\Delta Q$) sont ajout s un corps, nous observons une augmentation proportionnelle de a variation de température ($\Delta T$). Par cons quent, nous pouvons introduire une constante de proportionnalit a capacité calorique ($C$), appel e capacit thermique, qui tablit la relation suivante:
ID:(780, 0)